实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB- H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)="0.1mol/L " B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
 a(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。
a(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。 Y中SO2的含量,设计如下三种方案:
Y中SO2的含量,设计如下三种方案:
 mL容量瓶中
mL容量瓶中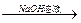 测定剩余固体质量。
测定剩余固体质量。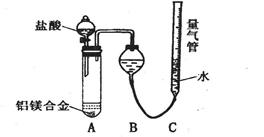
 测定生成气体的体积实验装置。
测定生成气体的体积实验装置。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号