常温下Ca(OH)2的Ksp=5.5×10-6,KspAg2SO4=" 1.2" ×10-5,KspAgCl=1.56×10-10,现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+ 阴离子有Cl-、OH-、HCO3-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
阴离子有Cl-、OH-、HCO3-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
① 测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
④在D溶液中滴加BaCl2溶液未看到白色沉淀
根据上述实验现象,回答下列问题:
(1)写出下列化合物的化学式:A C D E
(2)写出③中白色絮状沉淀变成红褐色过程中发生的化学反应方程式
(3)小骐同学欲将B、F混合,不小心将B、F倒入了稀盐酸中,马上看到有白色沉淀,你认为此白色沉淀中一定有 ,该同学还可以看到另一个现象,用离子方程式解释产生原因 。
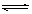 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为: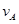 =0.15mol/(L·min)②
=0.15mol/(L·min)②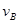 =0.01mol/(L·s)
=0.01mol/(L·s)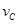 =0.40mol/(L·min) ④
=0.40mol/(L·min) ④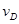 =0.45mol/(L·min),
=0.45mol/(L·min), 粤公网安备 44130202000953号
粤公网安备 44130202000953号