(4分)
(1)用系统命名法给下列物质命名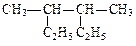
名称:
(2)下式是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”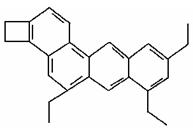
doggycene的分子式为
(4分)
(1)用系统命名法给下列物质命名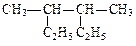
名称:
(2)下式是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”
doggycene的分子式为