元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
族
周期
|
I A
|
II A
|
IIIA
|
IVA
|
VA
|
VIA
|
VIIA
|
0
|
2
|
3 Li
锂
6.941
|
4 Be
铍
9.012
|
5 B
硼
10.81
|
6 C
碳
12.01
|
7 N
氮
14.01
|
8 O
氧
16.00
|
9 F
氟
19.00
|
10 Ne
氖
20.18
|
3
|
11 Na
钠
22.99
|
12Mg
镁
24.31
|
13 Al
铝
26.98
|
14 Si
硅
28.09
|
15 P
磷
30.97
|
16 S
硫
32.06
|
17 Cl
氯
35.45
|
18 Ar
氩
39.95
|
(1)请从上表中查出关于硼元素的一条信息:_____________________。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同。
(3)第11号元素与第17号元素组成的化合物是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)下图A、B、C是三种粒子的结构示意图.试回答下列问题:
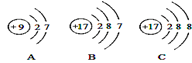
①A、B、C中属于同种元素的粒子是 ;
②A和B两种粒子的 相同,所以它们具有相似的化学性质;