|
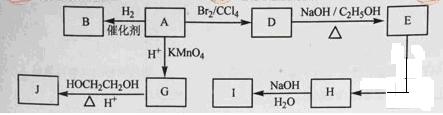
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为 。
(3)由
 A生成D的反应类型是 ,由D生成E的反应类型是 。
A生成D的反应类型是 ,由D生成E的反应类型是 。(4)G的分子式为C6H10O4, 0.146gG需用20ml0.100mol/L NaOH溶液完全中和,J是一种高分子化合物,则由G转化为J的化学方程式为 ;
(5)H中含有官能团是 , I中含有的官能团是 。
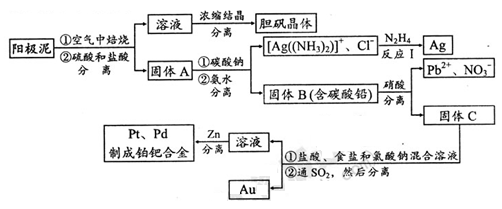
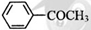 )是最简单的芳香酮,它是制备药物、调味剂、有机高聚物和催泪瓦斯等的中间体。合成苯乙酮有如下两条路线:
)是最简单的芳香酮,它是制备药物、调味剂、有机高聚物和催泪瓦斯等的中间体。合成苯乙酮有如下两条路线: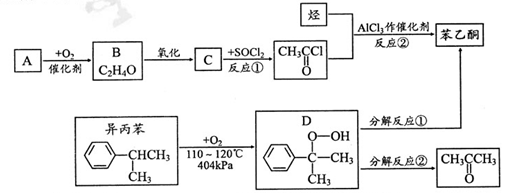
 粤公网安备 44130202000953号
粤公网安备 44130202000953号