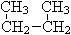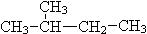过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:____________。
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是________。
(3)甲酸钙[ (HCOO)2 Ca]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中,则该反应的化学方程式为________。过氧化氢比理论用量稍多,其目的是________。反应温度最好控制在30 -70℃,温度不易过高,其主要原因是________。
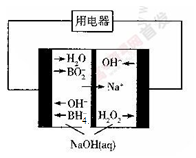
(4)下图是硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH_____(填“增大”、
“减小”或“不变”)。
(5)研究CO2的利用对促进低碳社会的构建具有重要意义。250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质
|
CH4
|
CO2
|
CO
|
H2
|
体积分数
|
0.1
|
0.1
|
0.4
|
0.4
|
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g) ===CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O (g) ===CO2(g)+H2 (g) △H="+2.8" kJ·mol-1
2CO(g)+O2(g) ===2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
 和
和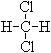 ;⑥
;⑥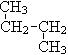 和
和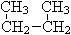
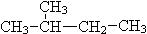
 和
和 ;⑥
;⑥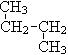 和
和