A是一种气态烃。B和D是生活中两种常见的有机物。以A为主要原料合成乙酸乙酯,其合成路线如下图所示: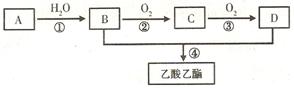
(1)A的结构式为_____________
(2)A—→B的反应类型为
(3)D的水溶液与氢氧化钠反应的离子方程式为
(4)B与钠反应的化学方程式为:____________________
(5)反应④的化学反应方程式为:____________________
A是一种气态烃。B和D是生活中两种常见的有机物。以A为主要原料合成乙酸乙酯,其合成路线如下图所示:
(1)A的结构式为_____________
(2)A—→B的反应类型为
(3)D的水溶液与氢氧化钠反应的离子方程式为
(4)B与钠反应的化学方程式为:____________________
(5)反应④的化学反应方程式为:____________________