下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: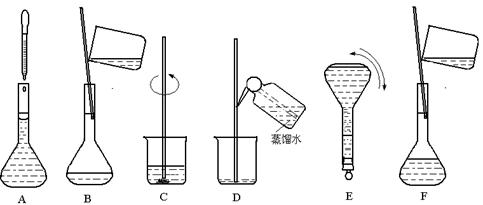
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是 。
(2)步骤B通常称为转移,步骤A通常称为  。
。
(3)将上述实验步骤A→F按实验过程先后次序排列 。
下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是 。
(2)步骤B通常称为转移,步骤A通常称为  。
。
(3)将上述实验步骤A→F按实验过程先后次序排列 。