在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应: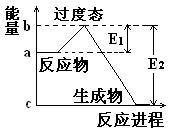
NO2+CO 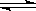 CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
(1)此段时间内,用CO2表示的平均反应速率为 。
(2)2 min时,CO 的转化率为 。
(3)假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量 (填“大于”、“小于”或“等于”)开始时容器内气体的总物质的量。
在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:
NO2+CO 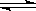 CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
(1)此段时间内,用CO2表示的平均反应速率为 。
(2)2 min时,CO 的转化率为 。
(3)假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量 (填“大于”、“小于”或“等于”)开始时容器内气体的总物质的量。