各物质间的关系如下图,其中、为气态单质。
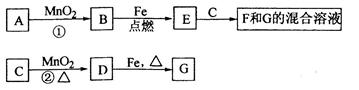
请回答下列问题:
(1)物质和的名称分别为、;
(2)可选用不同的进行反应①,若能在常温下进行,其化学方程式为;
若只能在加热情况下进行,则反应物应为;
(3)反应②的化学方程式为;
(4)新配制的溶液应加入以防止其转化为。检验溶液中阳离子的常用试剂是,实验现象为。
各物质间的关系如下图,其中、为气态单质。

请回答下列问题:
(1)物质和的名称分别为、;
(2)可选用不同的进行反应①,若能在常温下进行,其化学方程式为;
若只能在加热情况下进行,则反应物应为;
(3)反应②的化学方程式为;
(4)新配制的溶液应加入以防止其转化为。检验溶液中阳离子的常用试剂是,实验现象为。