过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
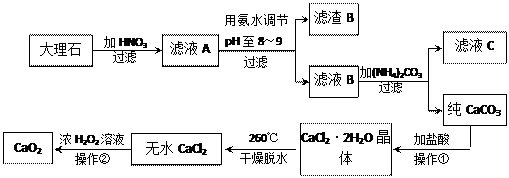 |
请回答下列问题:
(1)操作①应包括下列操作中的 (填序号)。
| A.溶解 | B.过滤 | C.蒸馏 | D.分液 E.蒸发结晶 |
(2)用氨水调节pH至8~9的目的是 。
(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+ (填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。;用简要的文字解释需用氢氧化钠调节pH至9~11的原因 。
(6)已知大理石含CaCO3的质量分数为a,mg大理石可以制得ngCaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率为

 溶液和
溶液和 溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的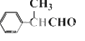 、PTT和DAP等化工产品。
、PTT和DAP等化工产品。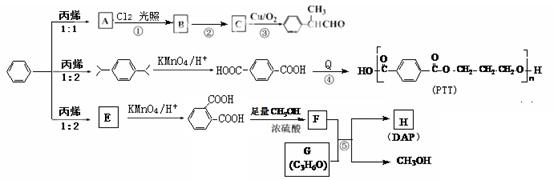
 直接反应,原因是 。
直接反应,原因是 。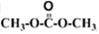 )发生酯交换反应,生成一种高分子化合物M和甲醇,写出M的结构简式 。
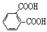
)发生酯交换反应,生成一种高分子化合物M和甲醇,写出M的结构简式 。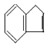 是一种碳氢化合物,它的一种同分异构体A,A分子中的碳原子不一定全在同-平面上,且A分子中苯环上只有一个取代基,A有如下变化关系:
是一种碳氢化合物,它的一种同分异构体A,A分子中的碳原子不一定全在同-平面上,且A分子中苯环上只有一个取代基,A有如下变化关系: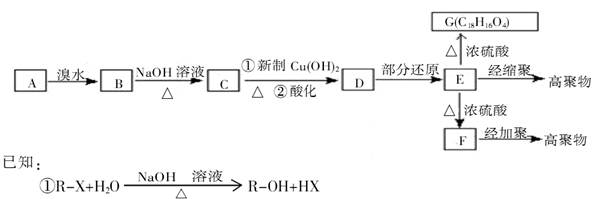
 粤公网安备 44130202000953号
粤公网安备 44130202000953号