现有A、B、C、D四种短周期主族元素,其原子序数依次增大,已知A、C位于同一主族,A元素在元素周期表中原子半径最小,B、D原子最外层电子数相等,且B、D原子序数之和是A、C原子序数之和的两倍。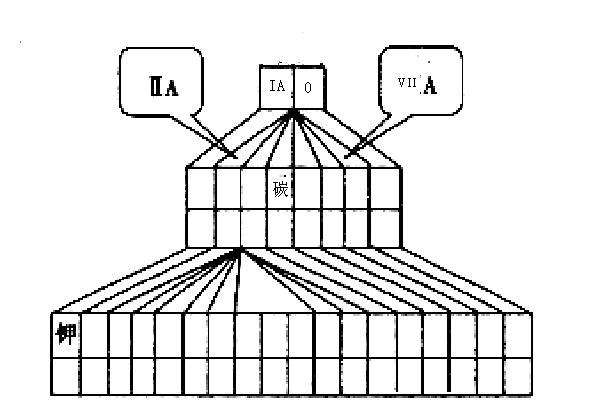
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出A、B、C、D四种元素的元素符号。
(2)图中将过渡元素涂黑。
(3)由上述四种元素中的某几种所形成的具有漂白作用物质的化学式(写出两种):_______、______。
现有A、B、C、D四种短周期主族元素,其原子序数依次增大,已知A、C位于同一主族,A元素在元素周期表中原子半径最小,B、D原子最外层电子数相等,且B、D原子序数之和是A、C原子序数之和的两倍。
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出A、B、C、D四种元素的元素符号。
(2)图中将过渡元素涂黑。
(3)由上述四种元素中的某几种所形成的具有漂白作用物质的化学式(写出两种):_______、______。