某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
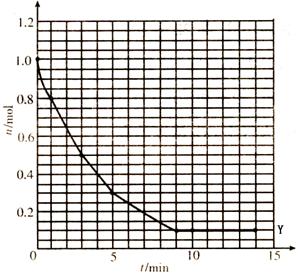
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验二放出氢气量减少的原因是 。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
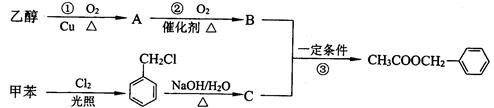
 反应的化学方程式:。
反应的化学方程式:。 ③白磷④氯气⑤
③白磷④氯气⑤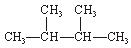
 Cl⑦
Cl⑦ Cl⑧红磷
Cl⑧红磷 粤公网安备 44130202000953号
粤公网安备 44130202000953号