一种溶液里可能含有OH-、Cl-、CO 、SO
、SO 四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验:
四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验:
(1)向第一支试管中滴入酚酞试液,溶液变红。
(2)向第二支试管中加入Ba(NO3)2溶液,有白色沉淀生成。
(3)向第三支试管中逐滴加入稀HNO3溶液,有无色气体生成,该气体能使澄清石灰水变浑浊;继续加入稀HNO3使溶液呈酸性时,再加入Ba(NO3)2溶液不产生沉淀。
试判断:该溶液中肯定含有___________离子,肯定没有___________离子,不能肯定有没有的是_________离子。(每空2分,共6分)

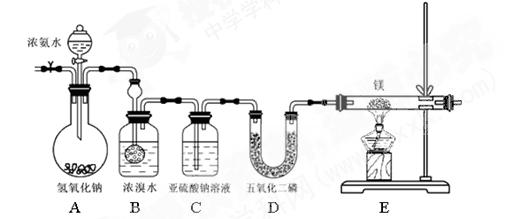
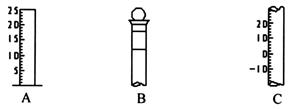
 。
。
 定后读数
定后读数 粤公网安备 44130202000953号
粤公网安备 44130202000953号