A 、B 、C 、D 、E 、F、G为原子序数依次增大的元素,其中前六种属于短周期元素。已知B 、C 、F 三种原子的最外层共有11 个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应并且生成盐和水。请完成下列问题:
(1)只根据以上条件一定能判断出的元素的及符合条件的离子的符号填写在下表空格处
编号
|
A
|
B
|
C
|
D
|
E
|
F
|
G
|
半径最小的离子
|
符号
|
|
|
|
|
|
|
|
|
 (2)写出B、C 的最高价氧化物对应的水化物间反
(2)写出B、C 的最高价氧化物对应的水化物间反
应的离子方程式____________
(3)己知D的单质在F单质中燃烧可生成X、Y两
种化合物并产生白色烟雾,写出X、Y中各原子
最外层均满足8 电子结构的分子的电子式___。
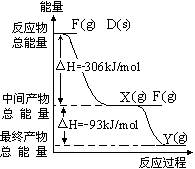
D、F的单质反应过程和能量关系如图所示(图
中的△H表示生成1mol产物的数据),写出指定
条件下两种单质作用生成Y时的热化学方程式
_______________________。
(4) G的单质是目前用途最广泛的一种金属材料,但在使用中受环境影响易被腐蚀,试写出发生腐蚀时的电极反应式_________________________________________。
(5)A与E能形成两种常见的化合物,这两种化合物中属于非极性分子的物质化学式_______