由淀粉和其他无机原料,合成环状化合物H: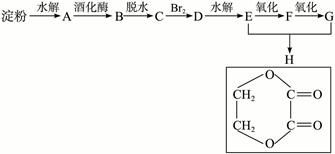
写出下列物质的结构简式:
| A.________________, | B._________________, | C._________________, | D._________________,E._________________,F._________________,G._________________。 |
由淀粉和其他无机原料,合成环状化合物H:
写出下列物质的结构简式:
| A.________________, | B._________________, | C._________________, | D._________________,E._________________,F._________________,G._________________。 |