下列反应中
①2KClO3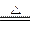 2KCl+3O2↑
2KCl+3O2↑
②C+CO2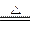 2CO
2CO
③HgS+O2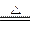 Hg+SO2
Hg+SO2
④2KMnO4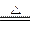 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑤2KNO3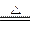 2KNO2+O2↑
2KNO2+O2↑
⑥Cl2+H2O====HClO+HCl
(1)属于一种元素还原两种元素的是__________。
(2)属于同种元素间氧化还原反应的是__________。
下列反应中
①2KClO3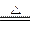 2KCl+3O2↑
2KCl+3O2↑
②C+CO2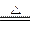 2CO
2CO
③HgS+O2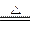 Hg+SO2
Hg+SO2
④2KMnO4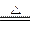 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑤2KNO3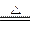 2KNO2+O2↑
2KNO2+O2↑
⑥Cl2+H2O====HClO+HCl
(1)属于一种元素还原两种元素的是__________。
(2)属于同种元素间氧化还原反应的是__________。