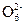为了预防碘缺乏病,国家规定每千克食盐中应含有40~50 mg的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428 g,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030 mol·L-1的硫代硫酸钠溶液滴定,用去18.00 mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下: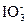 +5I-+6H+
+5I-+6H+ 3I2+3H2O
3I2+3H2O
I2+2S2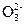
 2I-+S4
2I-+S4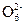
为了预防碘缺乏病,国家规定每千克食盐中应含有40~50 mg的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428 g,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030 mol·L-1的硫代硫酸钠溶液滴定,用去18.00 mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下: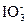 +5I-+6H+
+5I-+6H+ 3I2+3H2O
3I2+3H2O
I2+2S2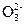
 2I-+S4
2I-+S4