某地区酸雨经检验除H+和OH-外,还含有Na+、Cl-、NH+4、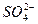 ,其浓度依次为7.0×10-6 mol·L-1,3.5×10-5 mol·L-1,2.3×10-5 mol·L-1,2.5×10-6 mol·L-1,则酸雨的pH为_______________。[已知pH=-lgc(H+)]
,其浓度依次为7.0×10-6 mol·L-1,3.5×10-5 mol·L-1,2.3×10-5 mol·L-1,2.5×10-6 mol·L-1,则酸雨的pH为_______________。[已知pH=-lgc(H+)]
某地区酸雨经检验除H+和OH-外,还含有Na+、Cl-、NH+4、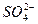 ,其浓度依次为7.0×10-6 mol·L-1,3.5×10-5 mol·L-1,2.3×10-5 mol·L-1,2.5×10-6 mol·L-1,则酸雨的pH为_______________。[已知pH=-lgc(H+)]
,其浓度依次为7.0×10-6 mol·L-1,3.5×10-5 mol·L-1,2.3×10-5 mol·L-1,2.5×10-6 mol·L-1,则酸雨的pH为_______________。[已知pH=-lgc(H+)]