教材中有一个演示实验:用脱脂棉包住约0.2 g Na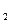 O
O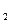 粉末,置于石棉网上,可观察到脱脂棉燃烧起来。
粉末,置于石棉网上,可观察到脱脂棉燃烧起来。
(1)由实验现象能得出的有关Na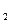 O
O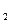 与水反应的结论是:a.有氧气生成;b.____________。
与水反应的结论是:a.有氧气生成;b.____________。
(2)某研究性学习小组拟用如右图所示装置进行实验,以证明上述结论。
①用以验证结论a的实验方法及现象是____________________________。
②用以验证结论b的实验方法及现象是____________________________。
教材中有一个演示实验:用脱脂棉包住约0.2 g Na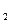 O
O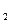 粉末,置于石棉网上,可观察到脱脂棉燃烧起来。
粉末,置于石棉网上,可观察到脱脂棉燃烧起来。
(1)由实验现象能得出的有关Na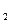 O
O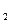 与水反应的结论是:a.有氧气生成;b.____________。
与水反应的结论是:a.有氧气生成;b.____________。
(2)某研究性学习小组拟用如右图所示装置进行实验,以证明上述结论。
①用以验证结论a的实验方法及现象是____________________________。
②用以验证结论b的实验方法及现象是____________________________。