在标准状况下,用以下气体做喷泉实验,请根据情况填写烧瓶中溶液的物质的量浓度(假设溶质不扩散)。
(1)用氯化氢气体,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度是_________。
(2)用混有空气的氨气,喷泉结束后,水充至烧瓶容积的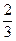 处,则溶液的物质的量浓度是_________。
处,则溶液的物质的量浓度是_________。
在标准状况下,用以下气体做喷泉实验,请根据情况填写烧瓶中溶液的物质的量浓度(假设溶质不扩散)。
(1)用氯化氢气体,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度是_________。
(2)用混有空气的氨气,喷泉结束后,水充至烧瓶容积的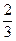 处,则溶液的物质的量浓度是_________。
处,则溶液的物质的量浓度是_________。