如图4-9,硬质玻璃管内,左、中、右分别放有3个湿润棉花球;a球浸有溴化钾溶液;b球浸有碘化钾浓溶液;c球中浸有KI淀粉溶液。实验时,从右端缓缓通入氯气,同时在b处微热,并逐渐向左移动酒精灯,则可以观察到: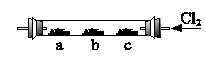
图4-9
(1)在a处有 产生。
(2)在b处有 色产生。
(3)c处变成 色。
(4)稍冷却后,b、c之间的管壁上有 色的 。
如图4-9,硬质玻璃管内,左、中、右分别放有3个湿润棉花球;a球浸有溴化钾溶液;b球浸有碘化钾浓溶液;c球中浸有KI淀粉溶液。实验时,从右端缓缓通入氯气,同时在b处微热,并逐渐向左移动酒精灯,则可以观察到: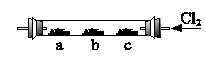
图4-9
(1)在a处有 产生。
(2)在b处有 色产生。
(3)c处变成 色。
(4)稍冷却后,b、c之间的管壁上有 色的 。