大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验。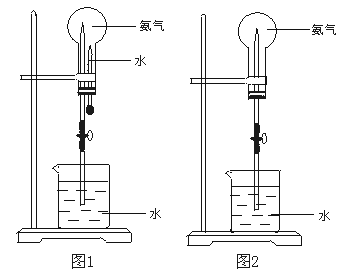
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 作干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 ,该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验。
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 作干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 ,该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。