1 mol的某有机物甲在O2中充分燃烧,可得到相同条件下等体积的CO2和H2O(g),并消耗112L(标准状况)O2;又知甲的相对分子质量小于100,1 mol甲在酸性条件下可水解生成1 mol乙和1 mol丙,且丙通过一定途径可转化为乙。
(1)甲的分子式为 。
(2)与甲分子式、所属物质类别都相同的有机物的同分异构体有 种(不含甲)。
已知:①ROH+HBr(氢溴酸)→ RBr+H2O
②RCH—CHR
1→ RCHO+R
1CHO
| |
OH OH
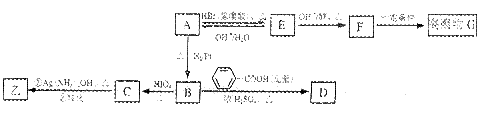
A与甲为同分异构体,且A中含有碳氧双键,B只生成C,与A相关的反应如下:
(3)写出E→F的反应类型:
。
(4)写出A、G的结构简式:A
、G
。
(5)写出下列转化的反应化学方程式:
B→D
;
C在反应条件为:①下发生反应的化学方程式为
。
(6)A在空气中久置,可转化为相对分子质量为86的化合物H,H的一氯代物只有一种,写出H的结构简式:
。