下图为盐酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和。已知废水中盐酸的质量分数为0.73%,且废水的流量为5.0kg / s(即每秒钟排出5kg废水)。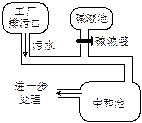
(1)若碱液是NaOH溶液,且流量为1.0kg/s,则该碱液的质量分数是多少?
(2)现将碱液改为K2CO3溶液,将实现既中和废水、又得到钾肥(KCl)之目的。若K2CO3溶液质量分数与NaOH溶液相等,则K2CO3溶液流量是多少?
下图为盐酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和。已知废水中盐酸的质量分数为0.73%,且废水的流量为5.0kg / s(即每秒钟排出5kg废水)。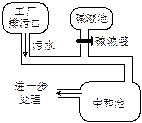
(1)若碱液是NaOH溶液,且流量为1.0kg/s,则该碱液的质量分数是多少?
(2)现将碱液改为K2CO3溶液,将实现既中和废水、又得到钾肥(KCl)之目的。若K2CO3溶液质量分数与NaOH溶液相等,则K2CO3溶液流量是多少?