下图中, 表示氧原子,
表示氧原子,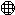 表示氢原子。根据此图,请从宏观、微观两个方面写出获得的化学信息。(可不填满,也可补充)
表示氢原子。根据此图,请从宏观、微观两个方面写出获得的化学信息。(可不填满,也可补充)
(1)_____________________________________________
(2)_____________________________________________
(3)_____________________________________________
(4)_____________________________________________
 H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
 ,列式并说明得出该常数的理由。
,列式并说明得出该常数的理由。 pC(g)+qD(g)。
pC(g)+qD(g)。 2Fe2++I2设计成带盐桥原电池。
2Fe2++I2设计成带盐桥原电池。 粤公网安备 44130202000953号
粤公网安备 44130202000953号