配平下列氧化还原方程式,并完成以下问题。
(1)P4+HNO3+H2O——H3PO4+NO↑,该反应中氧化产物是_____________________。
(2)Fe+H2SO4(浓)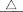 Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。
Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。
配平下列氧化还原方程式,并完成以下问题。
(1)P4+HNO3+H2O——H3PO4+NO↑,该反应中氧化产物是_____________________。
(2)Fe+H2SO4(浓)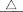 Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。
Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。