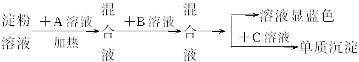
(1)各步所加的试剂为:A_____________,B_____________,C_____________。
(2)_____________(填“可以”或“不可以”)只加A溶液而不加B溶液,原因是____________________________________________________。
(3)当析出2.16 g单质沉淀时,淀粉的水解率为_____________。

(1)各步所加的试剂为:A_____________,B_____________,C_____________。
(2)_____________(填“可以”或“不可以”)只加A溶液而不加B溶液,原因是____________________________________________________。
(3)当析出2.16 g单质沉淀时,淀粉的水解率为_____________。