重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
(1)碱浸前将铭铁矿粉碎的作用是
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO2- 4转化为Cr2O2- 7,写出平衡转化的离子方程式
;
(4)用简要的文字说明操作⑤加入KCl的原因 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O2- 3=2I- +S4O2- 6)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
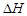 分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题: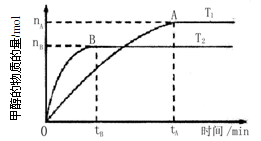
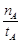 mol·L-1·min-1
mol·L-1·min-1 增大
增大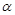 ,则容器内的压强与起始压强之比为.
,则容器内的压强与起始压强之比为. PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1
PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1 粤公网安备 44130202000953号
粤公网安备 44130202000953号