【12分】向100 mL 3 mol·L-1硫酸铝铵溶液中逐滴加入1 mol·L-1 Ba(OH)2溶液。
(1)写出刚好出现沉淀的总物质的量为最大值时的离子方程式(用一个式子表示):__________。
(2)随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。
写出B点和C点对应的Ba(OH)2溶液体积:B. _______________,C._______________。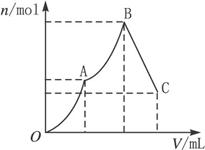
【12分】向100 mL 3 mol·L-1硫酸铝铵溶液中逐滴加入1 mol·L-1 Ba(OH)2溶液。
(1)写出刚好出现沉淀的总物质的量为最大值时的离子方程式(用一个式子表示):__________。
(2)随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。
写出B点和C点对应的Ba(OH)2溶液体积:B. _______________,C._______________。