如图a、b、c、d是一张浸有饱和食盐水的滤纸,E、F为铂片,其附近滴有两滴石蕊试液。X、Y由Cu、Zn组成。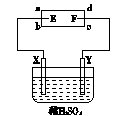
(1)若工作时,E附近出现蓝色,则E为 极;F为 极;Y 为极,Y材料为 。
(2)若E、F均为铜片,其余不变,则E、F的电极反应:E极 ,F极 。
如图a、b、c、d是一张浸有饱和食盐水的滤纸,E、F为铂片,其附近滴有两滴石蕊试液。X、Y由Cu、Zn组成。
(1)若工作时,E附近出现蓝色,则E为 极;F为 极;Y 为极,Y材料为 。
(2)若E、F均为铜片,其余不变,则E、F的电极反应:E极 ,F极 。