在一定条件下,x A (g)+y B (g)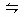 z C(g)的反应达到平衡。
z C(g)的反应达到平衡。
⑴已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z间的关系
是_________________________。
⑵已知C是气体,如果反应中x+y=z在增大压强时其平衡发生移动,则一定向
_____ __移动。
⑶已知C是气体,当其他条件不变,增大 A的物质的量时平衡不移动,则A是 态。
⑷加热后C的质量分数减小,则正反应是_________(填“放热”或“吸热”)反应。
在一定条件下,x A (g)+y B (g)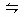 z C(g)的反应达到平衡。
z C(g)的反应达到平衡。
⑴已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z间的关系
是_________________________。
⑵已知C是气体,如果反应中x+y=z在增大压强时其平衡发生移动,则一定向
_____ __移动。
⑶已知C是气体,当其他条件不变,增大 A的物质的量时平衡不移动,则A是 态。
⑷加热后C的质量分数减小,则正反应是_________(填“放热”或“吸热”)反应。