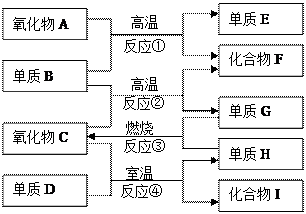
如上图,已知:
①单质E可作为半导体材料;
②化合物F是不能生成盐的氧化物;
③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
(1)化合物F是 。
(2)化合物I是 。
(3)反应③的化学方程式 。
(4)反应④的化学方程式 。

如上图,已知:
①单质E可作为半导体材料;
②化合物F是不能生成盐的氧化物;
③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
(1)化合物F是 。
(2)化合物I是 。
(3)反应③的化学方程式 。
(4)反应④的化学方程式 。