G和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO:中Si与O原子间不形成上述π健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健 。

 4Na2SO4+S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是(填写字母序号)。
4Na2SO4+S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是(填写字母序号)。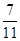 ,则SO2的转化率为。
,则SO2的转化率为。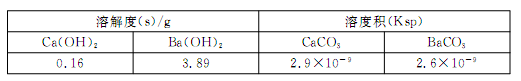


 +2ClO-+2OH-===Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-===Cu(OH)2↓+2N2H4↑+2Cl-+2H2O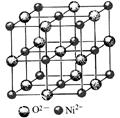

 FeS(s) + H2S(g)
FeS(s) + H2S(g) 1/2Fe(s)+H2S(g)
1/2Fe(s)+H2S(g)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号