广东省韶关市十校高三10月联考化学试卷
下列说法中,正确的是( )
| A.淀粉是天然高分子化合物 |
| B.甲醛广泛应用于食品加工 |
| C.溴乙烷和甲醇都能发生消去反应 |
| D.聚丙烯能使溴水褪色 |
下列各组离子在指定溶液中能大量共存的是( )
| A.在无色溶液中: Na+、Cu2+、NO3- 、MnO4- |
| B.在含有HCO3-的溶液中:H+、K+、SO42-、Cl- |
| C.pH=1的溶液中:Na+、 K+、AlO2-、SO42- |
| D.常温下,水电离的c(H+)=10-12mol·L-1的溶液中:K+、Ba2+、NO3-、Cl- |
NA代表阿伏加德罗常数。下列有关叙述正确的是(Fe-56 O-16)( )
| A.标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B.5.6g Fe与足量稀盐酸反应,转移电子数为0.2 NA |
| C.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| D.18g重水(D2 O)所含的电子数为10NA |
以下进行性质比较的实验设计,合理的是( )
| A.用NaOH溶液与FeCl3溶液制备Fe(OH)3胶体 |
| B.比较氯、溴非金属性:氯气通入溴化钠溶液中 |
| C.将混有SO2的CO2通入NaOH溶液中除去SO2 |
| D.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L-1NaOH溶液中 |
下列陈述I、 II正确并且有因果关系的是( )
| 选项 |
叙述I |
叙述II |
| A |
锌金属活动性比铁强 |
海轮外壳上装锌块可减缓腐蚀 |
| B |
Ba(OH)2可与盐酸反应 |
Ba(OH)2可用于治疗胃酸过多 |
| C |
SiO2是酸性氧化物 |
SiO2能与水反应生成硅酸 |
| D |
H2O2有氧化性 |
H2O2能使酸性高锰酸钾溶液褪色 |
短周期元素X、Y、Z原子序数之和为36,X2-与Y+具有相同的核外电子层结构,Y、Z位于同一周期。下列推测不正确的是 ( )
| A.同主族元素中X的氢化物稳定性最高 |
| B.同周期元素中Y的金属性最强 |
| C.原子半径Z>Y |
| D.同周期元素中Z的最高价氧化物的水化物酸性最强 |
用下列实验装置进行的实验中,不能达到相应实验目的的是( )
| A.用图①所示实验装置排空气法收集H2气体 |
| B.图②装置可以用来验证化学能转化为电能 |
| C.图③铁片最终完全溶解,且高锰酸钾溶液褪色 |
| D.图④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
下一代iPhone将在电池方面有所改进,该电池的一极为一种有机高分子游离基(用R表示)和石墨粉及粘结剂的复合物,另一极是锂,分隔材料为某种聚烯烃,电解质为LiPF6溶解于某种有机碳酸酯溶剂中。该游离基(R)在空气中十分稳定,在充电时被氧化成阳离子(Rx+),电池充放电的方程式为:xLi+Rx+ xLi++R。下列有关说法正确的是( )
xLi++R。下列有关说法正确的是( )
| A.放电时,该电池将电能转化为化学能 |
| B.充电时,Rx+由阴极向阳极移动 |
| C.放电时,负极反应为xLi-xe-=xLi+ |
| D.充电时,阳极反应为R-xe-=Rx+ |
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):
(1)香豆素的分子式为_______;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为______。
(2)反应②的反应类型是_____________,反应④的反应类型是_____________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为_______________。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下, 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物
的结构简式为_____________。
(16分)在一定条件下,NO与NO2混合可生成N2O3 ,反应的化学方程式为:
NO(g)+NO2(g) N2O3(l) △H<0
N2O3(l) △H<0
下图表示一定量的NO、NO2混合气体发生反应时,N02浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。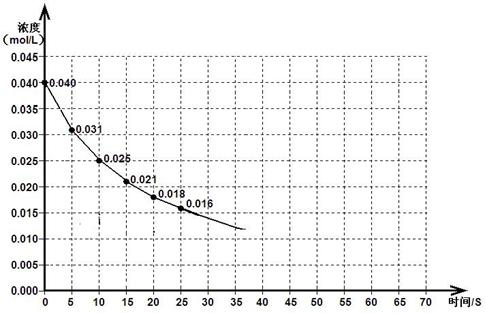
(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向______ _移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:______,该反应的氧化剂是______________。
实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。
(1)上述装置中各仪器从左至右的连接顺序为A接_ _接_ _接_ _接_ _接_ _接G。
(2)E装置的作用是________ __,D中的现象为___ _ ,B中的现象为_________。
(3)写出相关反应的离子方程式:A中____ ____ ___,G中_____________ _。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:(H-1 O-16 Fe-56)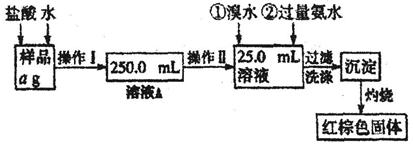
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有_______、_____(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式____________________________。
(3)检验沉淀是否已经洗涤干净的操作是_____________________________。
(4)该实验中可以回收利用的物质是________________________________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是___ (列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____(写出一种原因即可)。
(6)为进一步探究样品的性质,他们又利用溶液A做了如下一些实验,其中现象、结论均正确的_
______________(填写序号)。
A.向氢氧化镁悬浊液中滴加A溶液出现红褐色沉淀,证明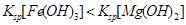 |
| B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色由黄色变成浅绿色 |
| C.向沸水中滴加A的饱和溶液,立即出现红褐色沉淀 |
| D.将A溶液加热蒸干并灼烧,得到Fe2O3固体 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号