浙江省温州市十校联合体高三上学期期初联考化学试卷
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.CO2分子比例模型: |
B.NH4I的电子式: |
| C.乙烯的结构简式 C2H4 | D.NaH中氢离子结构示意图为 |
分类是重要的科学研究方法,下列物质归类不正确的是( )
| A.电解质:明矾、冰醋酸、硫酸钡 |
| B.酸性氧化物:CO2、SO2、NO、SiO2 |
| C.混合物:铝热剂、矿泉水、水玻璃、漂白粉 |
| D.同素异形体:C60、C70、金刚石 |
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
| 选项 |
现象或事实 |
解 释 |
| A |
用浸泡酸性高锰酸钾溶液的硅土延长果实的成熟 |
利用乙烯可以发生加成反应 |
| B |
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 |
K2CO3与NH4Cl反应生成氨气会降低肥效 |
| C |
SO2能使品红溶液褪色 |
SO2具有还原性 |
| D |
FeCl3溶液可用于铜质印刷线路板制作 |
FeCl3能从含有Cu2+的溶液中置换出铜 |
下列关于有机化合物的说法正确的是( )
| A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
| B.戊烷(C5H12)有两种同分异构体 |
| C.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
| D.糖类、油脂和蛋白质均可发生水解反应 |
下列说法中正确的是( )
| A.把100mL3mol/L的硫酸与100mLH2O混合,硫酸的物质的量浓度变为1.5mol/L |
| B.用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 |
| C.用CO2鉴别NaAlO2溶液和CH3COONa溶液 |
| D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A.78g苯含有C=C双键的数目为3NA |
| B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| C.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D.含2molH2SO4的浓硫酸与足量铜片在加热条件下反应,一定能产生NA个SO2气体分子 |
二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理常采用:
2NaClO3 + 4HCl = 2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法中正确的是( )
| A.浓盐酸在反应中仅体现还原性 |
| B.每生成0.lmol ClO2转移0.5mol电子 |
| C.氧化性:NaClO3 <ClO2 |
| D.被氧化和被还原的物质的物质的量之比为1:1 |
下列有关溶液组成的描述合理的是( )
| A.常温下在c(H+)=1×10-13mol/L的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3- |
| B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾ |
| C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾ |
| D.无色溶液中可能大量存在K+、AlO2-、NO3-、HCO3- |
根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
| D.从第③步到第⑤步的目的是为了浓缩 |
下列叙述错误的是 ( )
(1)所有的碱性氧化物都是金属氧化物
(2)H2S水溶液是弱酸,HCl水溶液是强酸,可以验证硫元素的非金属性比氯元素弱
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物
| A.全部 | B.(1)(2)(3)(4) |
| C.(1)(2)(3)(5) | D.(2)(3)(4)(5) |
能正确表示下列反应的离子反应方程式为( )
| A.NH4HCO3溶于少量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O |
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3- 3Fe3++NO↑+3H2O 3Fe3++NO↑+3H2O |
| C.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2 |
D.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO ===BaSO4↓+H2O ===BaSO4↓+H2O |
下列叙述I和II均正确并有因果关系的是( )
| 选项 |
叙述I |
叙述II |
| A |
KNO3的溶解度大 |
用重结晶法除去KNO3中混有的NaCl |
| B |
BaSO4难溶于酸 |
用盐酸和BaCl2溶液检验SO42- |
| C |
NH3能使酚酞溶液变红 |
NH3可用于设计喷泉实验 |
| D |
Ca(OH)2能制成澄清石灰水 |
可配制2.0 mol∙L-1的Ca(OH)2溶液 |
X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体。W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是( )
| A.原子半径:W>Y>Z>X |
| B.气态氢化物的稳定性:X<Z |
| C.最高价氧化物对应水化物的碱性:Y>W |
| D.Y、Z的氧化物都有酸性和碱性 |
说法不正确的是( )
| A.金属汞洒落,必须尽可能收集起来,并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞 |
| B.滴定管、移液管在使用前要用待装液润洗,而容量瓶不用待装液润洗 |
| C.检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液。 |
| D.碘单质与食盐的分离常用升华法,而碘水中提取碘单质则常用萃取法。 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是( )
| A.正极反应式:Ca+2Cl- - 2e-= CaCl2 |
| B.常温时,在正负极间接上电流表或检流计,指针不偏转 |
| C.放电过程中,Li+向负极移动 |
| D.每转移0.1mol电子,理论上生成20.7g Pb |
下列溶液中微粒的物质的量浓度关系正确的是( )
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)=c(NH )=c(Cl-) )=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合: c(HCOO-)+ c(H+)>c(Na+)+c(OH-) |
| D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+) |
下列有关说法正确的是( )
| A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
C.CH3COOH 溶液加水稀释后,溶液中 的值增大 的值增大 |
| D.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )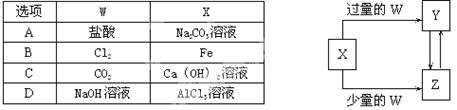
臭氧是理想的烟气脱硝剂,其脱硝反应为: 2NO2(g)+O3(g)  N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
| A |
B |
C |
D |
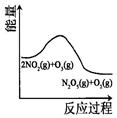 |
 |
 |
 |
| 升高温度,平衡常数减小 |
0~3s内,反应速率为: v(NO2)=0.2mol·L-1 |
t1时仅加入催化剂,平衡正向移动 |
到达平衡时,仅改变x,则x为c(O2) |
强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-
中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
下列结论正确的是( )
| A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42― |
| B.气体F经催化氧化可直接生成气体D |
| C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3 |
| D.X中不能确定的离子是 A13+、Na+、K+和C1― |
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。写出其中D与水反应生成的酸名称 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式 。
(14分)A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、
D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶
液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图 ,E元素在周期表中的位置是 。
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为 。
(3)D与C按原子个数比为1:1形成化合物的电子式是 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 (填具体的化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的化合物甲反应的离子方程式 。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中H+移向 (填“正”或“负”)极。
(7) E(s)+O2(g) EO2(g) △H1 E(g)+O2(g) EO2(g) △H2,则△Hl △H2(填“>”或“<”或“=”)。
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成配平:
Fe2++ ClO-+ = Fe(OH)3↓+ C1-+
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c ( H2 )减少 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 | D.重新平衡c ( H2 )/ c (CH3OH )减小 |
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
① 写出阳极电极反应式 。
② 写出除去甲醇的离子方程式 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号