题客网高考押题卷 第三期(新课标版)化学
化学无处不在,下列用品的有效成分及用途对应错误的是( )
| A.食盐既可以做调味剂,又可以做防腐剂 |
| B.纯碱既可以做清洗品,又可以做发酵粉 |
| C.漂白粉既可以做消毒剂,又可以做漂白剂 |
| D.酒精既可以做饮料,又可以做燃料 |
某醇烯酸是合成香精的主要原料,其结构简式为:
下列有关某醇烯酸的叙述正确的是
| A.该醇烯酸的分子式为C7H8O3 |
| B.既可以通过加聚反应形成高分子,也可以通过缩聚反应形成高分子 |
| C.不能使酸性高锰酸钾溶液褪色 |
| D.分子内形成六元环的酯 |
X、Y、Z、W的原子序数依次增大的短周期元素,其含氧酸根离子不能破坏水的电离平衡的是
A.XO |
B.YO |
C.ZO |
D.WO— |
锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如下图所示,其中两极区间的隔膜只允许Li+通过。电池充电时的总反应方程式为:LiCoO2==Li1-xCoO2+xLi。关于该电池的推论错误的是( )
A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应为xLi-xe-===xLi+
C.电解质溶液不能是水溶液
D.充电时,负极(C)上锂元素被氧化
相同温度下,将足量氯化银固体分别放入:①50mL蒸馏水 ②40mL 0.1 mol·L-1盐酸 ③20mL 0.1 mol·L-1氯化镁溶液 ④30mL0.1 mol·L-1硝酸银溶液中,Ag+浓度:
| A.①>④=②>③ | B.④>①>②>③ |
| C.④=②>①>③ | D.①>④>②③ |
用下列实验装置进行相应实验,能达到实验目的的是( )。
| 选项 |
A |
B |
C |
D |
| 装置 |
 |
 |
 |
 |
| 目的 |
除去Cl2中含有的少量HCl |
蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
制取少量纯净的CO2气体 |
分离CCl4萃取碘水后已分层的有机层和水层 |
雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下的离子方程式 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
①生成Ce4+从电解槽的 (填字母序号)口流出。
②写出与阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
(15分)高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的______周期______族。下面有关硅材料的说法中正确的是__________(填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料———光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰 |
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅。
已知: 
请将以下反应的热化学方程式补充完整:
SiO2(s) + 2C(s) ="==" Si(s) + 2CO(g) △H = ________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅。已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:_________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响。根据下表数据,可用________ 方法提纯SiHCl3。
| 物质 |
SiHCl3 |
SiCl4 |
AsCl3 |
| 沸点/℃ |
32.0 |
57.5 |
131.6 |
②用SiHCl3制备高纯硅的反应为SiHCl3(g) +H2(g)  Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。
Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:____________________。
(15分)铜的氯化物是重要的化工原料,广泛地用作有机合成催化剂。
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。
按要求回答下列问题:
(1)操作①的玻璃仪器有________________________,检验溶液2中是否含有杂质离子的操作是 。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ;
溶液1可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)___________。
a.NaHCO3 b.NH3·H2O c.CuO d.Cu2(OH)2CO3
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式: 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验大试管加热前要进行一步重要操作,其操作是 。
②反应时,盛粗铜粉的试管中的现象是 。
【化学一选修2:化学与技术】(15分)
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: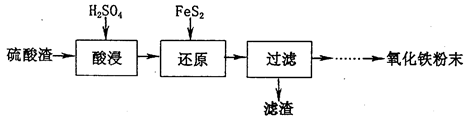
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO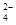 ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl
Sn2++4Cl-+2HgCl2="==" SnCl +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O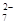 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Mg(OH)2 |
Mn(OH)2 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
9.4 |
8.3 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________;b.沉淀:_____________________________;
c.分离,洗涤;d.烘干,研磨。
【物质结构与性质】
碳元素可以组成不同的单质和化合物。
(1)碳原子的电子排布图为_______________
(2)由C和同周期的元素组成的分子如图a,推测分子式是____________,键角为_______。 图a
图a
(3)CO2分子的结构式为__________,与它等电子体的分子有___________;
(4)第ⅡA金属碳酸盐分解温度如下:
| |
BeCO3 |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
| 分解温度 |
100℃ |
540℃ |
960℃ |
1289℃ |
1360℃ |
碳酸盐中CO碳原子是________杂化,其空间构型为________________。
解释上列碳酸盐分解温度越来越高的原因是_________________________。
(5)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图2 晶胞结构,化学式为____________________。Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
在晶胞中,给出的平行六面体的棱长单位为nm,相对原子质量Li:7、C:12。
则锂电池负极材料的密度为_____________g·cm-3(用含a、b代数式表示)。

图2 图3
[化学—选修5:有机化学基础](15分)
(15)蓓萨罗丁( )是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,有研究者设计其合成路线如下(部分反应试剂和条件已略):
)是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,有研究者设计其合成路线如下(部分反应试剂和条件已略):
已知:Ⅰ.  Ⅱ.
Ⅱ.
试回答下列问题:②③⑥
(1)蓓萨罗丁的分子式是 ; F分子中官能团的名称为 、 。
(2)原料A的核磁共振氢谱的峰面积之比为 ;原料B发生反应④所需的条件为 。
(3)反应①~⑥中属于的取代反应类型的有 (填序号)。
(4)E物质具有的性质是__________________。
a. 属于芳香烃
b.与Br2在不同条件下既能发生加成反应,也能发生取代反应
c.与酸性高锰酸钾反应,化学键只一处断裂
(5)反应②的化学方程式分别为__________________________。
(6)对苯二甲酸有多种同分异构体,写出符合下列条件的同分异构体的结构简式 。
①苯环上有三个取代基,且均匀分布;②能与浓溴水发生沉淀反应;③能发生银镜反应。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号