中考化学易错题集 化学基本实验与科学探究之填空题
实验室部分仪器或装置如图所示,请回答下列问题
(1)实验室常用石灰石和稀盐酸制取二氧化碳气体,发生装置可选择图中的 (填仪器字母)进行组装,反应的化学方程式为
(2)在制取过程中,小雨同学选用F装置收集二氧化碳,并用燃着的小木条放在瓶口验证二氧化碳是否收集满,结果发现小木条始终不灭,说明该瓶气体没有集满。出现上述情况的原因可能是1 ,
2 ,3 (写出其中3条)。
(3)采用上述方法制取的二氧化碳中常含有氯化氢气体和水蒸气,为获得纯净、干燥的二氧化碳气体,可选用图所示的H装置和I装置进行除杂和干燥,导管口连接的正确顺序是:气体→ →F。
(4)在实验室中制取氢气,发生装置与制二氧化碳的相同,收集方法可采用 (填“向上”或“向下”)排空气法。若用如图J所示装置采用“排空气法”收集氢气,请在图中将导管补画完整。
(届上海市崇明县第一学期期末试题)已知草酸 (H2C2O4) 加热时在浓硫酸的催化作用下会发生分解反应,某化学兴趣小组对草酸分解的产物产生了兴趣,请你参与:
【提出猜想】甲:CO2 H2O 乙: CO H2O
丙:NH3 CO2 H2O 丁: CO2 CO H2O
①某同学认为丙同学的猜想是错误的,理由是 (11) 。
【查阅资料】氧化铁为红棕色粉末,一定温度CO能还原氧化铁;铁粉呈黑色。
【进行实验】为了验证上述猜想,将草酸在一定条件下分解的产物依次通过下列装置:
② A、B装置的顺序不能颠倒,原因是 (12) 。
③实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红棕色粉末变成黑色,由此推断 、(13) 同学猜想成立。
④ D装置的作用是 (14) ,反应的化学方程式为 (15) 。
【得出结论】⑤草酸分解的化学方程式为 (16) 。
【反思与评价】⑥从环保角度考虑,上述实验的不足之处是 (17) 。
已知A—H均为初中化学常见的物质。其中A、C是组成元素相同的气体,且C能产生温室效应;B为红棕色,是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀。根据右图所示的转化关系(图中反应条件均已略去),请回答:
(1)写出下列物质的化学式:B 、C ;
(2)写出下列反应的化学方程式:① ;
② ,反应②的基本反应类型是 。
(届上海市静安区一模试题)小敏来到实验室完成氧气和二氧化碳气体的制取实验,请按照要求答问题:
①实验台前有如下仪器和药品,请写出仪器A、B的名称:A (1) ,B (2) 。
小敏利用上述仪器和药品可以做制取氧气的实验,实验前她发现其中缺少一种药品,该药品名称是 (3) ;该反应的原理是(用化学方程式表示) (4) 。
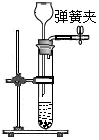
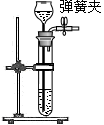
②下表是小敏实验时的主要步骤及相关实验装置,其中 (5) (填字母序号)步骤中的实验装置有错误,改正的方法是 (6) 。
改正后进行实验,这些步骤的正确操作顺序是 (7) (填字母序号)
| 实验 步骤 |
a.制备气体 |
b.收集气体 |
c.检查装置气密性 |
d.清洗仪器、整理桌面 |
| 相关 实验 装置 |
 |
 |
 |
 |
③利用上述装置另选药品,也能完成二氧化碳气体制备,制取二氧化碳的化学方程式为 (8) 。
④下图甲装置也可制取二氧化碳气体,甲装置的优点是可随时控制反应的发生和停止。若打开弹簧夹,
固体与液体接触,反应便能发生,请简述使甲装置中反应停止的原理 (9) 。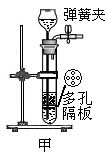
(届北京市海淀区第一学期期末)根据下图回答问题。
(1)仪器a的名称是 。
(2)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为 ,应选用的装置是 (填序号),收集一瓶二氧化碳时,将燃着的木条放在瓶口,若观察到 ,说明瓶中已充满二氧化碳。
(3)取一朵用石蕊溶液染成紫色的干燥小花,将小花的一半用水喷湿,放入装置C中,可观察到的实验现象是 ,此现象说明CO2具有的化学性质是 。
(4)小明在查阅资料时发现镁条能在CO2中燃烧,他在装置D中进行实验,发现镁条剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体。这个实验使你对物质燃烧的条件产生的新认识是 。
根据下列实验装置图回答问题:
(1)写出a的仪器名称 ;
(2)实验室制备和收集O2的装置组合是 (填字毋序号);写出此套装置制备O2对应的化学方程式: ;
(3)用B装置制取O2时检查气密性的方法是 ;
(4)氢气是一种无色.无味、难溶于水的气体,其密度比空气的密度小,在实验室中常用锌粒和稀硫酸反应制取。
①实验室制取氢气的发生装置是 (填字毋序号);
②氢气与氧气混和点燃可能会发生爆炸,因此点燃之前必须先 。
(届江苏省宜兴市第一学期期末试题)小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。
[查阅资料]
①真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金;
②铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],碱式碳酸铜受热易分解生成CuO、H2O和CO2。据上述资料可推知,碱式碳酸铜由 种元素组成。
[实验探究]
将该枚生满铜绿的戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。
(1)小明认为:气体中除了含有CO2外,还可能含有的气体是 。产生该气体的化学反应方程式为 。
(2)小华认为蓝绿色溶液中除含有氯化锌外,还应该含有 、 。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了现象:① ,② ,从而证实了自己的观点。
(3)小娟取适量新制的FeCl2溶液,加入锌粒,一段时间后,溶液颜色变浅。发生反应的化学方程式为 。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是 。
(4)小明想进一步探究“金戒指”中铜元素的质量分数,取一枚同材质的“金戒指”,称得质量为3.8g。在老师的指导下,将“金戒指”经浓硝酸氧化、碱化等步骤处理后,最终得到纯净的氧化铜,称得质量仍然为3.8g(实验过程中铜元素损失忽略不计)。则“金戒指”中铜元素的质量分数是多少?(写出计算过程)
如图是某同学鉴别碳酸氢铵、硫酸铵、硝酸铵三种化肥的过程(反应条件未标出),请回答下列问题:
(1)步骤①中通过观察到 现象,可以鉴别出碳酸氢铵。
(2)步骤②中所需试剂可以选用两种不同类别(按酸、碱、盐、氧化物进行分类)的物质,其化学式分别为 、 。
请写出硫酸铵分别与这两种试剂发生反应的化学方程式: 、 。
(届北京市房山区第一学期期末试题)根据下图回答问题。
(1)仪器a的名称是 。
(2)实验室制取二氧化碳所选用的发生装置是 (填装置序号,下同),不选择装置E收集二氧化碳的原因是______________________。
(3)实验室用高锰酸钾制取氧气反应的化学方程式是 _____________________ ,所选用的收集装置是E或 。主要的实验步骤有:①加热 ②装药品并固定试管 ③检查装置的气密性 ④用排水法收集氧气 ⑤停止加热 ⑥将导管从水槽中取出。正确的操作顺序是 _____________ (用序号表示)。
“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 |
硫酸的质量分数(均取20mL) |
锌的形状(均取1g) |
氢气的体积(mL)(均收集3分钟) |
| ① |
20% |
锌粒 |
31.7 |
| ② |
20% |
锌片 |
50.9 |
| ③ |
20% |
锌粒 |
61.7 |
| ④ |
30% |
锌片 |
79.9 |
(1)写出稀硫酸与锌反应的化学方程式__________________________________________。
(2)小兵用右图装置收集并测量氢气的体积,其中量筒的作用是_______________________,氢气应从_______(填e或f或g)管通入。
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________。
【得出结论】(4)结论是_______________________________________________________。
【评价与反思】(注意:若答对(5)(6)两小题奖励4分,化学试卷总分不超过60分)
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) |
第1分钟 |
第2分钟 |
第3分钟 |
第4分钟 |
第5分钟 |
第6分钟 |
| H2的体积 |
3.1mL |
16.7mL |
11.9mL |
9.6mL |
7.6mL |
6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因_______________________________________________。
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证_______________________________。
(届北京市东城区第一学期期末试题)已知A、B、C、D、E五种物质中均含有某种相同的非金属元素,B为无色液体,C为黑色固体。图中“→”表示物质之间的转化关系。五种物质的转化关系如图所示(图中反应条件及部分反应物或生成物省略)。
(1)A、C的化学式分别是_______、_______。
(2)A→B的化学方程式是_______。
(3)D→B的化学方程式是_______。
(4)E转化为B和D反应的化学方程式是 。
实验室利用如图所示装置进行相关实验,请回答下列问题:
(1)若用高锰酸钾制取氧气,应选用的发生装置是 (填字母);实验结束后,某同学发现水槽中的水变成了浅紫红色,从实验操作角度分析其原因是 ;若用B和D装置制取氧气,B中发生反应的化学方程式: 。
(2)若要制取二氧化碳,选用的块状固体药品为 ;若用F装置检验二氧化碳,应在其中装入适量的 ,出现 现象时,证明有二氧化碳产生。
(3)若要制取氢气,可以使用C或E装置收集,能用E装置收集的原因是 ;若选用F装置代替C装置收集氢气,气体应从 (填“a”或“b”)导管口通入。
(届黑龙江省伊春市伊春区第一学期期末试题)根据下图所示,回答有关问题:
(1)写出图中标有字母的仪器名称:a 。
(2)实验室用高锰酸钾制取氧气,应选用的发生装置是 (填字母),实验时该装置试管口应放一团棉花,其目的是 ;反应的化学方程式为 。实验结束,停止加热前要先将导管移出水面,目的是 。(3)实验室制取二氧化碳气体时如果用E装置收集该气体,则气体应从 端进入(填“b”或“c”)。请写出实验室制CO2的化学方式 。通常用澄清石灰水来检验二氧化碳,反应的化学方程式为 。
如果发生装置选用C,其优点是 ;
(4)若D装置中盛有紫色石蕊溶液,通入CO2气体后,溶液变 ,原因是 。(用化学方程式表示)
已知A、B、C、D四种物质中含有相同的金属元素,A为红色固体,C、D中含元素种类相同,B→A反应过程较为复杂。“→”表示一种物质转化成另一种物质,四种物质的转化关系如下:
(1)C物质的化学式是___________________。
(2)A→B化学方程式为________________________;
(3)B→D化学方程式为______________,该反应能够发生的原因是____________________________。
(届河北省初中毕业生结课小模拟考试)实验室常用下图装置制取有关气体,请回答下列问题:
(1)写出A装置中标有序号仪器的名称:a ,b ;
(2)实验室用KClO3和MnO2两种固体混合加热制取O2,实验的基本操作有:①给试管加热②检查装置的气密性③收集气体④装药品⑤把导管移出水面⑥固定装置⑦停止加热。正确的操作顺序为_____________________(用序号填写),此反应的化学方程式为 。
(3)实验室用过氧化氢溶液和二氧化锰制取O2应选择上图中的__________装置(填 A或B),此反应的化学方程式为 ,检验集气瓶中已充满氧气的方法是 。利用此装置制取O2,若反应较为剧烈,为了减缓反应速率,以下措施正确的是 。
①加热反应物②用体积较小的锥形瓶③控制液体的滴加速度
某化学兴趣小组回收利用废旧干电池。
实验 1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可于水。兴趣小组的同学们设计回收物质的流程如图 1所示。
(1)操作1 和操作2 的名称都是____________,该操作中玻璃棒的作用是____________。
(2)灼烧滤渣 l 的目的是________________________ 。
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度____氯化锌的溶解度(填“<”、“=”或“>”)。
实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
①应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
②若用排水法收集并测定气体的体积,气体从装置B导管口____(填“ a ”或“ b ” ) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是________。
(5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 |
试剂 |
前10 min内产生的氢气体积(mL) |
|
| 不同纯度的锌 |
不同体积和浓度的稀硫酸 |
||
| a |
纯锌 |
30 mL 30 % |
564.3 |
| b |
含杂质的锌 |
30 InL 30 % |
634.7 |
| c |
纯锌 |
30 mL 20 % |
449.3 |
| d |
纯锌 |
40 mL 30 % |
602.8 |
①比较实验 a 和实验 b ,可以得到的结论是________________________。
②为了研究硫酸浓度对反应快慢的影响,需比较实验_____和实验_____(填编号)。
③控制其他条件相同,需控制的条件是______________________(例举一种条件即可)。
(届江苏省宜兴市第一学期期末试题)某化学兴趣小组选用下图所示装置,进行有关气体的制取和性质实验,请回答下列问题:
(1)写出有标号仪器名称:① ,② 。
(2)选用A装置制取氧气的化学方程式为 ;实验时在试管口放一团棉花,其作用是 ;用排水法收集氧气的合适时机是 。
(3)若B与F连接,则F中出现的现象是 ,原因是 (用化学方程式表示)。若B与G连接,则G中发生反应的化学方程式为 。
(4)若B与H连接,则H中低的蜡烛先熄灭,高的蜡烛后熄灭,由此说明了CO2的性质有 、 。
A、B、C、D、E是初中化学常见物质,转化关系如图(其中部分生成物和反应条件已略):已知B是黑色固体,相对分子质量为80,E是然气的主要成份,请回答下列问题:
(1)B是______,E是_____(均填化学式)。
(2)A→C的化学方程式为_________________________;
E→D的化学方程式为_________________________;
若B→A是复分解反应,化学方程式为_________________________;
(3)已知:Cu2O是红色固体,难溶于水,与稀硫酸反应的化学方程式如下:Cu2O+H2SO4=Cu+CuSO4+H2O若B→A是置换反应,在发生置换过程可能发生副反应生成Cu2O,产生为红色固体,其产物组合可能有____种,小思同学称取14.4g产物与足量的稀硫酸充分反应后,经过滤,洗涤、干燥,得到固体8.6g,则产物的成分为 ______________。
(届北京市海淀区第一学期期末)某同学欲探究市售 “双钙防蛀”牙膏、“皓清”牙膏和牙粉的主要成分。

【查阅资料】
(1)牙膏和牙粉均是由摩擦剂、活性剂、香料等成分构成。
(2)常用的摩擦剂有极细颗粒的碳酸钙(CaCO3) 和水合硅酸(SiO2·nH2O)等
(3)牙膏和牙粉中除了碳酸钙以外,其它物质均不与稀盐酸反应产生气体。
【实验一】探究“两种牙膏和牙粉中是否都含有碳酸钙?
| 步骤 |
实验操作 |
实验现象 |
| ① |
 如图所示,取三只试管分别加入适量待测样品,再分别加入适量R 溶液。R 溶液是 。 |
A试管中无明显变化, B和C试管中有无色气体生成。 |
| ② |
将B和C试管中生成的无色气体通入澄清石灰水。 |
现象Ⅱ: 。 |
实验结论: 。
【实验二】比较样品中碳酸钙的含量
| 步骤 |
实验操作 |
实验现象 |
| ① |
组装两套右图装置进行实验。分别取 (操作Ⅰ),放于锥形瓶中。并在分液漏斗中分别加入等质量的R 溶液。 |
|
| ② |
打开分液漏斗注入一定量R 溶液,然后关闭活塞。 |
有气泡产生。 |
| ③ |
待②反应结束后,再打开分液漏斗,注入一定量R 溶液,然后关闭活塞。 |
无明显现象 |
| ④ |
称量反应后装置及药品的总质量并加以比较 |
加入“双钙防蛀”牙膏的装置及药品的总质量大于加入牙粉的装置及药品的总质量 |
实验结论:_____________________________________________________;
步骤③的作用是: 。
【反思】
(1)若不改动原有装置和基本步骤,要测定牙粉中碳酸钙的质量分数,还应测定的数据有:______;
(2)小明认为该实验前不需要测定装置的气密性,请你说明其原因 。
以下是中学常见的实验装置图(图1)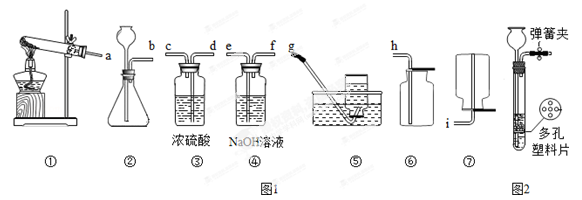
(1)实验室用锌粒和稀硫酸反应制取氢气,要制备并收集干燥的氢气,请将所选装置接口按从左到右顺序连接为 。
(2)实验室制取氧气有多种方法。
a,用KMnO4制氧气应选用 作为发生装置(填装置序号)。检验该装置气密性的方法是 。
b.如用H2O2溶液制氧气,除H2O2溶液外还需要加入的试剂是 (填名称)。如图2是实验室制备气体的一种装置图,该装置的特点是:打开弹簧夹,块状固体和液体接触,反应发生;关闭弹簧夹后,产生的气体将液面压回,使固体和液体分开,反应停止。用H2O2溶液制氧气时, (填“可以”或“不可以”)采用此装置。
c.实验室还用KClO3来制备氧气,该反应的化学方程式为 。将KClO3与MnO2的混合物ag加热一段时间,得到bg固体,将得到的固体溶于水,过滤、洗涤、干燥后,又得到cg固体,则KCl03的分解率为 。(用含a,b.c的式子表示)(提示:KCl03的分解率是指已分解KClO3质量与原加入KClO3质量之比)
(届湖北省武汉市部分学校第一学期期末试题)A、B、C、D都是初中化学常见的物质。它们之间的转化关系如右图所示(“→”表示物质间的转化关系)。
(1)若A和D均为单质,B和C是氧化物且组成元素相同,常温下B、C、D都是气体,A为黑色固体粉末。自然界中,绿色植物可实现C→D的转化。
A的化学式为 ;
B→C反应的化学方程式为 。
(2)若A、B、D都是氧化物,A和B组成元素相同,C为单质且常温下为气体。A的化学式为 ;
C的化学式为 ;D→B反应的化学方程式为 。
某白色粉末状固体甲,可能含有硫酸钠、氢氧化钠、碳酸钠、氯化钠;某溶液乙可能含有硝酸钡、氯化钠。为探究它们的成分,某化学小组开展了下图所示的实验。
请回答下列问题:
溶液A呈_______(填“酸性”、“中性”、“碱性”)。步骤Ⅱ中分离混合物的方法是________________。
固体甲中一定含有的物质是_________________,滤液C中除了指示剂外还含有的溶质是_____________。
根据步骤Ⅳ不能确定固体甲中某物质一定存在,其理由是_______________。要证明甲中该物质的存在,需补充的实验操作是________________________,观察现象。
(2013河北)乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二: ;猜想三:Ca(OH)2。
他的依据是 。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是:
。
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到 ,证明猜想二不成立。
(二)取少量白色固体加入到水中,取上层清液, ,有白色沉淀出现,证明猜想三成立。该反应的化学方程式为: 。
结论:白色固体是Ca(OH)2。
【拓展应用】已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是 (选填图中装置序号)。
(届北京市海淀区第一学期期末)某小组利用下图装置完成O2、 CO或CO2的有关实验, 实验过程中,他们从a处通入一种气体,在b处放入一种固体。C处放入一种溶液。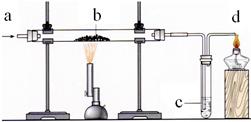
(1)若从a处通入O2,观察到b 处发出白光,c处的无色溶液变浑浊,则b处放置的黑色固体为 ,c处发生反应的化学方程式为 。
(2)若b处固体由红色变为黑色,且反应后的固体可被磁铁吸引,c处紫色溶液变红。则b处发生反应的化学方程式为 ,d处酒精灯的作用是 。
(3)若b处固体由红色变为黑色,b处反应后的固体不能被磁铁吸引,c处澄清石灰水不变浑浊。则b 处发生反应的化学方程式为 。
下图中的A~I表示几种初中化学常见的物质,其中A、D、I是氧化物,I中两种元素质量之比为3:4;B元素在地壳中的含量位居第三;C由三种元素组成;G为紫红色。图中“—— ”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
(1)写出G的化学式 ;E的化学式 。
(2)写出B→A反应的化学方程式 。
(3)反应①、②和③的基本反应类型相同,该基本反应类型是 。
(4)写出H与D反应的化学方程式 。
(届四川省彭州市第一学期期末测试)A是鸡蛋壳、贝壳、石灰石的主要成分,B、F是元素组成相同的气体,E、G是黑色固体,根据下列关系(部分产物略去),完成下列各题。
(1)C的俗名是 ,E的化学式 ;
(2)③的化学方程式是 ,利用F这一性质可 ,在做此实验时,除检查装置气密性外,加热前应 ,目的是 ;
④的化学方程式 ,反应的基本类型是 ,该反应是 (填“吸热”或“放热”)反应。
酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有 生成。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:
| 实验操作 |
测定结果 |
白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 |
pH>7 |
|
| |
CaCl2 |
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。
某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
| 部分物质的溶解性表(室温) |
||||
| |
OH- |
Cl- |
SO |
CO |
| H+ |
|
溶、挥 |
溶 |
溶、挥 |
| Ba2+ |
溶 |
溶 |
不溶 |
不溶 |
| Ca2+ |
微溶 |
溶 |
微溶 |
不溶 |
| Mg2+ |
不溶 |
溶 |
溶 |
微溶 |
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入Na2CO3溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充。
(4)LiOH和NaOH的化学性质相似。“神舟”飞船内,可用盛有LiOH的过滤网吸收航天员呼出的气体,以降低CO2含量。请计算:用LiOH完全吸收176 g CO2生成Li2CO3和H2O,理论上至少需要LiOH的质量是多少?
物质王国举行一场趣味篮球赛。某队由铁、二氧化碳、硫酸、氢氧化钙、氯化铜五名“队员”组成,比赛中,由氯化铜“队员”发球,“队员”间传接球,最后由D位置“队员”投篮进球完成一次有效进攻。场上“队员”位置及传球路线如图所示。
(1)已知D位置上投篮的“队员”是个灭火“能手”,则D位置“队员”代表的物质是 ;
(2)B位置“队员”所代表物质的一种用途是 ;
(3)写出连线④代表的物质间发生反应的化学方程式 ;连线①代表的物质间发生化学反应的基本类型是 反应。
化学小组同学为鉴定某工厂排出的无色污水成分,他们查阅工厂的有关资料后,推测出污水中可能含有HCl、Na2SO4、NaOH、Na2CO3中的一种或几种物质,同学们取污水进行了探究:(已知Na2SO4溶液呈中性)
(1)测污水的pH:取一张pH试纸,放在玻璃片上________________________,读数为pH=2,由此可知:污水中一定有_____________,可能有Na2SO4。
(2)检验Na2SO4是否存在:甲同学在一支试管中取少量污水,向试管中滴加少量的_______________溶液,振荡,产生了白色沉淀,反应的化学方程式为____________________,证明污水中有Na2SO4存在。乙同学用物理方法也得到了同样的结论,他的实验操作及实验现象是_________________________。
通过探究,同学们确定了污水的成分。
为使排放的污水中不含酸或碱,可向污水中加过量的________________________。
(2013吉林)2013年中央电视台举办的“3.15”晚会,曝出某品牌金饰品掺假的事件,引起同学们的好奇。某化学兴趣小组在老师的帮助下,对几种常见金属饰品所含的金属进行了相关的探究活动。
【提出问题】
(1)怎样鉴别真假黄金?
(2)怎样确定钯的金属活动性?
【查阅资料】
(1)假黄金通常是黄铜(Cu-Zn合金);
(2)钯(Pd)呈银白色,有金属光泽,可用作饰品。
【实验药品】钯、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
【实验探究】
(1)鉴别黄金样品的真假
取黄金样品于试管中,滴加稀盐酸后,观察到黄金样品表面有气泡产生,该气体是 ,说明此样品为 (选填“真”或“假”)黄金。
(2)探究钯的金属活动性
依据生活经验,同学们猜想钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 把钯浸入硝酸银溶液中 |
. |
钯的活动性比银弱 |
| 把铂浸入氯化钯溶液中 |
无明显现象 |
钯的活动性比铂 |
初步得出结论:钯、银、铂的金属活动性由强到弱的顺序为 。
【废液处理】
(1)转化成沉淀。小组同学将所有液体倒入废液缸中,出现白色沉淀。写出产生该现象的化学方程式
(写出一个即可);
(2)通过科学合理的方法进一步回收金属钯。
(2013陕西)小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成。他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究。
【提出问题】反应后溶液中溶质的成为是什么?
【猜想假设】
猜想①Na2SO4、Na2CO3
猜想②Na2SO4、Na2CO3、NaOH
猜想③Na2SO4、H2SO4、Na2CO3
猜想④Na2SO4、 H2SO4
猜想⑤Na2SO4
上述猜想中,你认为不合理的是猜想__(填序号)。
【实验探究】⑴小鹏取少量该溶液于试管中,向其中滴加无色酚酞,发现溶液颜色无变化,据此,他认为猜想⑤是正确的。你认为他的结论是__(填“合理”或“不合理”)的,理由是 。
⑵小明向盛有少量氧化铜粉末的试管中加入适量该溶液,振荡,溶液变蓝。该反应的化学方程式是 。
【实验结论】根据上述实验探究,你认为猜想___(填序号)是正确的。
【拓展应用】工厂与实验室的酸性废水必须处理至中性再排放,这样做的意义是 (答一点即可)。
如下图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示。
| 实验编号 |
容器I |
针筒I |
容器II |
针筒II |
红墨水液面位置 |
| a |
二氧化碳(充满) |
10mL澄清石灰水 |
二氧化碳(充满) |
10mL水 |
保持左高右低 |
| b |
0.55g锌 |
15mL盐酸 |
0.24g镁 |
15mL盐酸 |
|
(1)实验开始前红墨水左右两端液面保持相平。容器I、II体积相同,装置气密性良好。
(2)实验a中,容器I内产生的现象是_____________________________。红墨水液面位置发生变化的原因____________________________________________________________(用化学方程式表示)。
(3)实验b中,针筒I、II内盐酸足量且溶质质量分数相同,产生气泡更剧烈的容器是________(填“I”或“II”),(4)红墨水的位置变化情况是_____________________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号