[上海]2013届上海市闵行区高三下学期三模考试化学试卷
下列有机化工与其产品用途不对应的是
| A.石油分馏:航空煤油 | B.重油裂化:导电塑料 |
| C.煤的干馏:炼铁焦炭 | D.乙烯水化:有机溶剂 |
化学与科技、社会、环境密切相关,下列说法不符合科学原理的是
| A.高纯硅制作光导纤维 | B.石墨制作火箭发动机喷管 |
| C.地沟油水解制取肥皂 | D.有机垃圾发酵生产沼气 |
下列化学表述正确的是
A.氯化钠的晶体模型: |
B.铍原子最外层的电子云图: |
| C.次氯酸的结构式:H-O-Cl |
| D.CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
向FeCl3和BaCl2的混合液中通入过量SO2,有白色沉淀产生。下列说法正确的是
| A.白色沉淀为BaSO3 | B.该实验表明FeCl3有还原性 |
| C.反应后溶液酸性增强 | D.反应后滴加KSCN溶液显红色 |
2012年诺贝尔化学奖获得者利用 I研究G蛋白偶联受体,下列说法正确的是
I研究G蛋白偶联受体,下列说法正确的是
| A.I元素的质量数是131 | B.I元素的中子数是78 |
| C.I原子5p亚层有一个未成对电子 | D.I原子有53个能量不同的电子 |
BF3与BCl3分子的空间构型均为平面正三角形,下列有关二者的比较中,正确的是
| A.分子中各原子最外层都满足8电子稳定结构 |
| B.键角均为60°,都是含有极性键的极性分子 |
| C.BF3沸点低于BCl3沸点,因为B-F键键长短 |
| D.BF3分子稳定性高于BCl3,因为B-F键键能高 |
原子晶体干冰具有类似SiO2的晶体结构,下列有关它的推断中,错误的是
| A.它可作耐磨材料 |
| B.它不可用作致冷剂 |
| C.晶体中每个碳原子形成2个碳氧双键 |
| D.晶体中碳、氧原子个数之比为1:2 |
下列事实不能用勒夏特列原理解释的是
| A.配制氯化铁溶液时,加入少量稀盐酸 |
| B.配制氯化亚铁溶液时,加入少量铁屑 |
| C.在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 |
| D.在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
已知:S(s)+O2(g)→SO2(g) +297.16kJ,2SO2(g)+O2(g) 2SO3(g)+196.6 kJ,下列说法正确的是
2SO3(g)+196.6 kJ,下列说法正确的是
| A.1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 |
| B.将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 |
C.S(g)+O2(g) SO2(g)+Q,Q值小于297.16 kJ SO2(g)+Q,Q值小于297.16 kJ |
| D.当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
有关下图电化学装置的叙述中,正确的是
| A.若X为碳棒,Y为饱和食盐水,K置于N,则铁极上析出氯气 |
| B.若X为铂棒,Y为CuCl2溶液,K置于N,则铁棒质量将增加 |
| C.若X为锌棒,Y为海水,K置于M,形成对铁的外加电流阴极保护 |
| D.若X为铜棒,Y为稀硫酸,K置于M,则正极反应为:Fe−2e→Fe2+ |
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如下图所示,下列判断正确的是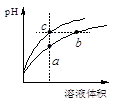
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三点溶液水的电离程度a>b>c |
| D.与等体积b、c处溶液反应,消耗等量的NaOH |
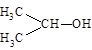 可简写为
可简写为 。达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图,有关它的说法错误的是
。达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图,有关它的说法错误的是
| A.达菲是一种磷酸盐 |
| B.达菲分子中含有肽键 |
| C.达菲的分子式为C16H31N2O8P |
| D.1mol达菲可与2mol H2发生加成反应 |
下列试管实验的方案中,一定能达到实验目的是
| A.制备乙酸丁酯:加入正丁醇和乙酸,再滴加几滴浓硫酸,振荡,水浴加热 |
B.检验甲基橙试液中是否混有微量酚酞:按图所示上升纸上层析法实验 |
| C.检验醛基:加入CuSO4溶液和NaOH溶液各1mL,振荡,加入乙醛溶液,煮沸 |
| D.比较苯酚、乙酸、碳酸的酸性:乙酸和纯碱反应产生的气体通入苯酚钠溶液中 |
用化学反应气体体积测定仪(如图),测定电石的纯度,为了减小实验误差,下列措施中不可行的是
| A.反应前后抽气使B中导管内外液面持平 |
| B.用饱和食盐水代替A装置中的蒸馏水 |
| C.把A装置浸入盛有冰水混合物的水槽中 |
| D.在B装置中的硫酸铜溶液表面覆盖一层苯 |
NA表示阿伏加德罗常数,有关NA的正确说法是
| A.1mol D318O+中含有的中子数为10NA |
| B.标准状况下,22.4L水中含O-H键数为2NA |
| C.某温度时1L pH=6的纯水所含OH-离子数为1.0×10-6NA |
| D.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA |
根据下表提供的数据可知能大量共存的微粒组是
| 化学式 |
电离常数(25℃) |
| CH3COOH |
Ki =1.7×10-5 |
| HClO |
Ki =3.0×10-8 |
| H2CO3 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
A.H2CO3、HCO3-、CH3COO-、ClO-
B.HClO、 HCO3-、CH3COO-、ClO-
C.HClO 、HCO3-、ClO-、CO32-
D.HCO3-、CH3COO-、ClO-、CO32-
已知NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,则两溶液中各粒子物质的量浓度的关系一定正确的是(R表示S或C)
A.c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-)
B.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
C.c(Na+)>c(HRO3-)>c(H+)>c(OH-)>c(RO32-)
D.c(HRO3-)>c(H2RO3)>c(OH-)>c(RO32-)>c(H+)
下列化学反应的离子方程式不正确的是
A.Na2S溶液中加入少量FeCl3溶液:2Fe3++S2- 2Fe2++S↓ 2Fe2++S↓ |
| B.向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应: Ca2++2OH-+2HCO3-  CaCO3↓+2H2O+CO32- CaCO3↓+2H2O+CO32- |
C.向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O SO42-+Cl-+2H+ SO42-+Cl-+2H+ |
D.Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: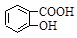 +CO32- +CO32-  +HCO3- +HCO3- |
测定Cu(NO3)2·nH2O的结晶水含量,下列方案中不可行的是
| A.称量样品→加热→冷却→称量CuO |
| B.称量样品→加热→冷却→称量Cu(NO3)2 |
| C.称量样品→加NaOH→过滤→加热→冷却→称量CuO |
| D.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g。若硝酸的还原产物只有NO,下列说法正确的是
| A.上述测定不能达到实验目的 | B.剩余的7.48g金属为铜 |
| C.共生成NO气体 0.04mol | D.该合金中铜的质量分数为69.2% |
海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为 ;与其同周期相邻且单质为固体的元素原子的核外电子排布式为 。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为 (用离子符号表示),其中形成的化合物中能发生潮解的是 (用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
①铍铝硅酸盐的氧化物形式的化学式: 。
②Be(OH)+与强碱溶液反应的离子方程式: 。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是 (选填编号)。
a.海水提溴:海水浓缩
 溴蒸气
溴蒸气

 液溴
液溴
b.海水提镁:海滩贝壳
 石灰乳
石灰乳

 MgO
MgO 镁
镁
c.海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体
d.海盐提纯:海盐

 精盐
精盐

 滤液
滤液
 食盐晶体
食盐晶体
2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标。研究表明,PM2.5约60%来源于某些气体污染物在空气中转变而成的二次颗粒物。这些气体污染物主要有二氧化硫、氮氧化物、氨气、挥发性有机物。因此,控制、治理PM2.5污染源成为环保的重要课题。
(1)研究表明,TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,如图所示,OH与NO2的反应为NO2+OH HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
(2)如图所示的电解装置能吸收和转化NO2、NO和SO2。阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生。请将S2O42-吸收NO2的离子方程式配平,并标明电子转移的方向和数目。
____S2O42-+____NO2+____OH- SO32-+____N2+____
SO32-+____N2+____

(3)已知上述电解装置阳极反应为:SO2-2e-+2H2O SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为 。
SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为 。
(4)PM2.5产生的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自扬尘等;2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等。请你结合信息,给出降低PM2.5排放的对策(至少两条): ______ 。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g)−131.4 kJ。
CO(g)+H2(g)−131.4 kJ。
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5miin的平均反应速率为_________________________。
(2)能说明该反应已达到平衡状态的是________(选填编号)。
a.v正 (C)= v逆(H2O) b.容器中CO的体积分数保持不变
c.c(H2)=c(CO) d.炭的质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2经如下两步反应制得甲酸甲酯:
①CO(g) + 2H2(g) CH3OH(g) ②CO(g) + CH3OH(g)
CH3OH(g) ②CO(g) + CH3OH(g) HCOOCH3(g)
HCOOCH3(g)
①反应①中CO的平衡转化率(α)与温度、压强的关系如图所示。在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
②已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则5.04kgCO最多可制得甲酸甲酯 kg。
对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验: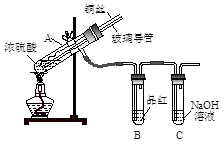

(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是 。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有 。
(3)确定乙是否煅烧完全的操作是 。
(4)煅烧过程中一定发生的化学反应方程式为 。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。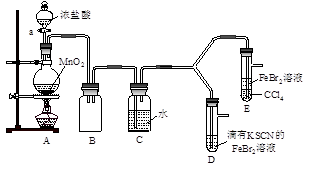
(5)根据下列实验操作和现象,填写实验结论。
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因____ ;
请设计简单实验证明上述解释 。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图: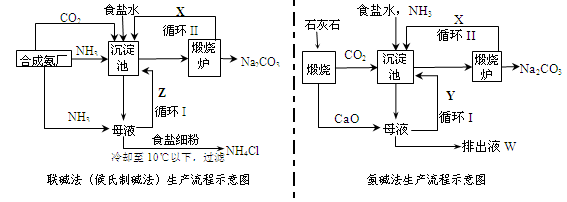
(1)两种方法的沉淀池中均发生的反应化学方程式为_____________________________。
(2)若沉淀池含800.00 mol NH3的水溶液质量为54.00 kg,向该溶液通入二氧化碳至反应完全,过滤,得到滤液31.20kg,则NH4HCO3的产率为______________%。
(3)在氨碱法生产过程中氨要循环使用,但不需要补充,在母液中加生石灰前先要加热的原因是 ___ 。
(4)根据联碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是_______(选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联碱法的另一项优点是__________________________________________________。
(6)从沉淀池析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
| 滴定次数 |
待测液(mL) |
0.6000mol/L盐酸溶液的体积(mL) |
|
| 初读数 |
终读数 |
||
| 第一次 |
20.00 |
1.00 |
21.00 |
| 第二次 |
20.00 |
如右图Ⅰ |
如右图Ⅱ |
①第二次滴定,从图Ⅰ图Ⅱ 显示消耗的盐酸溶液体积为 。
显示消耗的盐酸溶液体积为 。
②该实验测定NaHCO3含量的计算式为ω(NaHCO3)= 。
③该同学测定结果有一定的误差,产生该误差的原因可能是 (选填编号)。
a.待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色
b.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
c.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
d.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定
某芳香烃X(相对分子质量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为(C7H5NO)。 
已知: (苯胺,易被氧化)
(苯胺,易被氧化)
完成下列填空:
(1)X的结构简式是 ,反应⑤的类型是 。
(2)反应②③两步能否互换 (填“能”或“不能”),理由是____________________ 。
(3)反应④的化学方程式是 。
(4)检验B是否完全转化为C的方法是 (选填编号)。
a.定量分析:测熔点 b.定性分析:酸性高锰酸钾溶液
c.定量分析:银氨溶液 d.定性分析:新制氢氧化铜
香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2。该芳香内酯A经下列步骤转变为水杨酸、乙二酸等物质。 
(1)写出化合物A的结构简式_____________________。
(1)上述转化过程中,属于取代反应的有____个;反应步骤B→C的目的是______________。
(1)化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体(不含C-O-O-结构)共有_____种。
(1)鉴别A、B、C三种物质,所需的试剂是________(选填编号)。
a.饱和FeCl3溶液,新制Cu(OH)2悬浊液 b.饱和FeCl3溶液,酸性KMnO4溶液
c.饱和FeCl3溶液,NaOH溶液 d.饱和FeCl3溶液,饱和NaHCO3溶液
(1)设计合理方案,由 合成
合成 ,写出相关化学反应方程式。
,写出相关化学反应方程式。
钠及其化合物在生产和生活中有广泛的应用。例如:Na2O2在医院、潜水、高空飞行中用作供氧剂。
(1)制备Na2O2的反应为:4Na+O2 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。
①实验测得某过氧化钠样品含有少量氧化钠杂质,其中钠、氧原子个数比为10︰9.5,该样品中Na2O2的纯度为 。
②取上述过氧化钠样品7.64g放入烧杯中,加入足量水,搅拌,使固体完全溶解,冷却后,在容量瓶中配制成100mL溶液,则该溶液中OH-离子的物质的量浓度为 。
(2)某同学为了检验引起光化学烟雾的气体成分(NO、CO、NO2、HCHO、CH3OH、CH4等),查阅资料得知:Na2O2+2NO→2NaNO2、Na2O2+2NO2→2NaNO3,于是取用a gM气体与b g 氧气混合后,用电火花不断引燃,充分反应后,气体通过足量Na2O2,Na2O2固体质量增加c g。
①若a=c,则M气体的成分可能含有 。
②若2a=c,则M气体可能是什么气体?通过计算回答。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号