[天津]2012年普通高等学校招生全国统一考试理综化学部分
根据下列物质的化学性质,判断其应用错误的是()
| A. | 酒精能使蛋白质变性,可用于杀菌消毒 |
| B. | 能与 反应,可作工业废气的脱硫剂 |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
| D. | 镧镍合金能大量吸收 形成金属氢化物,可作储氢材料 |
下列单质或化合物性质的描述正确的是
下列叙述正确的是
| A. | 乙酸与丙二酸互为同系物 |
| B. | 不同元素的原子构成的分子只含极性共价键 |
| C. | 和 是中子数不同质子数相同的同种核素 |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
| A |
B |
C |
D |
|
| 实 验 |
用提取 溴水中的 |
除去乙醇 中的苯酚 |
从和的固体 混合物中回收 |
配制100 mL 0.1000 · 溶液 |
| 装 置 或 仪 器 |
 |
 |
 |
 |
下列电解质溶液的有关叙述正确的是
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的 =7 |
| B. | 在含有 沉淀的溶液中加入 固体, 增大 |
| C. | 含l 的溶液与l 完全反应后,溶液中 |
| D. | 在 溶液中加入适量 ,可使 |
已知  ;。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 和1 ;(乙) 1 和0.5 ;(丙) 2 。恒温、恒容下反应达平衡时,下列关系一定正确的是
;。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 和1 ;(乙) 1 和0.5 ;(丙) 2 。恒温、恒容下反应达平衡时,下列关系一定正确的是
、、、、五种元素分属三个短周期,且原子序数依次增大。、同主族,可形成离子化合物;、同主族,可形成、两种分子。
请回答下列问题:⑴ 在元素周期表中的位置为
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是
⑶ 、的单质或两元素之间形成的化合物可作水消毒剂的有
⑷ 的燃烧热,写出燃烧反应的热化学方程式:
⑸的电子式为
⑹ 熔融状态下,的单质和能组成可充电电池(装置示意图如下),反应原理为:
2+  ;放电时,电池的正极反应式为
;放电时,电池的正极反应式为

萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下:

已知:
请回答下列问题:
⑴ 所含官能团的名称是
⑵ 催化氢化得,写出在一定条件下聚合反应的化学方程式:
⑶ 的分子式为
① 核磁共振氢谱有2个吸收峰 ② 能发生银镜反应
(4) 、的反应类型分别为
⑸ 的化学方程式为
⑹ 试剂的结构简式为
⑺ 通过常温下的反应,区别、和的试剂是
⑻ 与催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物,写出的结构简式:
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某"变废为宝"学生探究小组将一批废弃的线路板简单处理后,得到含70%、25%、4%及少量、等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
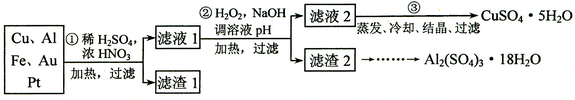
请回答下列问题:
⑴ 第①步与酸反应的离子方程为;
得到滤渣1的主要成分为。
⑵ 第②步加的作用是,使用H2O2的优点是;调溶液pH的目的是使生成沉淀。
⑶ 用第③步所得·制备无水的方法是。
⑷ 由滤渣2制取·18 ,探究小组设计了三种方案:

上述三种方案中,方案不可行,原因是;
从原子利用率角度考虑,方案更合理。
⑸ 探究小组用滴定法测定·5 (=250)含量。取试样配成100 溶液,每次取20.00 ,消除干扰离子后,用 标准溶液滴定至终点,平均消耗溶液。滴定反应如下:
+ = +
写出计算·5质量分数的表达式=;
下列操作会导致·5含量的测定结果偏高的是。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用还原可得到金属钨,其总反应为:

请回答下列问题:
⑴ 上述反应的化学平衡常数表达式为
⑵ 某温度下反应达平衡时,与水蒸气的体积比为2:3,则的平衡转化率为
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 |
第一阶段反应的化学方程式为
⑷ 已知:温度过高时,转变为;


则 的
的
⑸ 钨丝灯管中的在使用过程中缓慢挥发,使灯丝变细,加入可延长灯管的使用寿命,其工作原理为:  。下列说法正确的有
。下列说法正确的有
a.灯管内的可循环使用
b.在灯丝上分解,产生的又沉积在灯丝上
c.在灯管壁上分解,使灯管的寿命延长
d.温度升高时,的分解速率加快,和的化合速率减慢
 粤公网安备 44130202000953号
粤公网安备 44130202000953号