[上海]2012届上海市崇明县中考二模化学试卷
下列物质性质的表述中,属于化学性质的是………( )
| A.石墨能导电 | B.镁呈银白色 | C.碳有还原性 | D.蔗糖易溶于水 |
小刚测定了下列4种日用品的pH,其中呈酸性的是 …………………………………( )
| 日用品 |
A.洁厕灵 |
B.洗涤灵 |
C.洗发水 |
D.消毒液 |
| pH |
1 |
7 |
9 |
12 |
下列烹饪用的调味品与足量水充分搅拌,不能形成溶液的是………………( )
| A.食盐 | B.黄酒 | C.白糖 | D.橄榄油 |
水是生命之源。下列对水的认识正确的是…………( )
A.电解水生成的氧气和氢气的体积比约为 |
| B.水是由2个氢原子和1个氧原子构成的 |
| C.自然界中净化水的方法有吸附、沉淀、过滤等 |
| D.在河水中加入明矾可除去所有杂质 |
下列物质中,属于复合肥料的是……………………( )
| A.K2CO3 | B.CO(NH2)2 | C.KNO3 | D.Ca(H2PO4)2 |
化学符号及含义正确的是…………( )
| A.铵根:NH3 | B.2个氮原子:2N2 |
| C.胆矾:CuSO4·5H2O | D.氧化钡:Ba2O |
对于反应 来说,下列说法错误的是 …………………( )
来说,下列说法错误的是 …………………( )
A.若A、B、C、D都是化合物,则该反应可能是复分解反应
B.若A、C为单质,B、D为化合物,该反应一定是置换反应
C.若生成物C、D分别为硫酸铜和水,该反应一定是中和反应
D.若A为酸,B为碱,则C和D中有一种是盐
下列对实验现象的描述,错误的是……( )
| A.打开盛有浓盐酸的试剂瓶瓶盖,瓶口上方出现白雾 |
| B.硫在空气中燃烧产生明亮的蓝紫色火焰 |
| C.镁条在空气中剧烈燃烧,发出耀眼白光 |
| D.氢氧化钠溶液滴入氯化铁溶液,出现红褐色沉淀 |
现有碳酸钾、碳酸钙、硫酸铜三种白色的固体粉末,用最经济、简便,现象明显的方法鉴别,应选用下列试剂中的………( )
| A.蒸馏水 | B.紫色石蕊试液 | C.稀盐酸 | D.烧碱溶液 |
下列有关物质性质与用途的对应关系错误的是……( )
| A.稀有气体的惰性——制成电光源 | B.活性炭的吸附性——用于防毒面具 |
| C.氢气的可燃性——作火箭的燃料 | D.生石灰与水反应——作某些气体干燥剂 |
下列图像能正确体现与实验对应关系的是…………( )
| A.在一定温度下,向一定质量的硝酸钾饱和溶液中不断加入硝酸钾晶体 |
| B.向氢氧化钠溶液中加稀硫酸直至恰好完全反应 |
| C.给盛有氯酸钾和二氧化锰固体的试管加热 |
| D.少量红磷在盛有空气的密闭容器中燃烧 |
工业上用甲和乙反应制备燃料丙。根据下列微观示意图得出的结论中,正确的是…( )
A.甲的化学式为CH2 B.反应中甲、乙、丙的分子个数比为
C.甲、乙、丙都是有机物 D.丙中C、H、O元素的质量比为
下列依据实验目的所设计的实验操作中,正确的是( )
| 选项 |
实验目的 |
实验操作 |
| A |
鉴别稀HCl和稀H2SO4 |
加AgNO3溶液 |
| B |
鉴别KCl溶液和NaCl溶液 |
进行焰色反应 |
| C |
除去CaO中的CaCO3 |
加H2O 溶解、过滤 |
| D |
除去CuO中的Cu |
通过H2后加热 |
某白色固体混合物中可能含有碳酸钠、碳酸钾和碳酸镁,经实验测定其中碳元素的百分含量是12%,问关于该物质的叙述中正确的是…………( )
| A.该物质中一定含有碳酸钾 | B.该物质中一定含有碳酸钠 |
| C.该物质中一定含有碳酸镁 | D.以上结论都不正确 |
浩瀚的大气是大自然对人类的恩赐,与人类的生存休戚相关。
(1)空气中氧气的体积分数约为 ;
(2)植物通过光合作用,可将二氧化碳转化为氧气,光合作用的化学方程式为:6CO2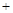 6X
6X C6H12O6
C6H12O6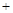 6O2,则X的化学式为 ;
6O2,则X的化学式为 ; mol O2中约含有 个氧原子;
mol O2中约含有 个氧原子;
(3)“节能减排”是我国的重要国策,下列大气中属于“减排”对象的是 (填序号);
| A.N2 | B.CO2 | C.O2 | D.H2O(气) |
人类的生产和生活都离不开金属。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是 ;
(2)铁是应用最广泛的金属,铁锈(主要成分Fe2O3)中铁元素以 (填“游离态”或“化合态”)存在;稀硫酸除铁锈的反应方程式为 ;
(3)在CuSO4和ZnSO4的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生,则滤出的固体是______(填名称),滤液中一定含有的溶质为_______________(用化学式表示),有关反应的化学方程式为_______________________。
下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答:
| 温度/℃ |
20 |
30 |
40 |
50 |
60 |
|
| 溶解度 g/100g水 |
NaCl |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
| KNO3 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
(1)20℃时,氯化钠的溶解度为 ;
(2)要配制一定溶质质量分数的氯化钠溶液时,溶解过程所需要的仪器有 ;
(3)现有操作步骤:a.溶解 b.加热浓缩 c.降温结晶 d.过滤;若KNO3晶体中含有少量NaCl,提纯KNO3的操作步骤是(填序号) ;
(4)60℃时,100g KNO3饱和溶液恒温蒸发10g水,会有 g硝酸钾晶体折出;
(5)向l00g 10%的KNO3溶液中加入12.5g KNO3固体,完全溶解后,所得溶液中溶质质量
分数为____________。
碳酸钠是一种重要的盐类物质,某同学设计实验对碳酸钠的部分性质进行了探究。请你一起参与探究活动
(1)【探究实验一】 碳酸钠溶液的酸碱性
【实验方案】 取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色。结论: 。
(2)【探究实验二】 能与碱反应。
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入澄清石灰水,振荡。
现象: 。反应的化学方程式为: 。
某兴趣小组为了检验在氢气和二氧化碳的混合气体中是否混有一氧化碳,用下图所示装置进行实验。试回答:
(1)装置B中盛放的试剂是___________,目的是为了_____________________________;
(2)当观察到_______________________________时,说明混合气体中一定混有一氧化碳。
根据实验装置图,回答下列问题:
(1)图中标有a的仪器名称是 ;
(2)实验室用氯酸钾和二氧化锰制取较纯氧气的装置组合是 (填装置编号),化学方程式为 ;
(3)实验室用锌粒和稀硫酸制氢气, (填“能”或“不能”)用装置D作发生装置;
(4)氢气还原氧化铜的实验可选 装置(填装置编号);实验时发现试管破裂,分析其中原因可能是 ;
(5)根据实验室制取O2、CO2二种气体的反应原理、制取与收集方法。请你归纳出实验室制取气体反应的共同点 (填序号)。
①需要加热 ②使用催化剂 ③没有气体参加反应
④原料为纯净物 ⑤只生成一种气体
(6)若用下图装置进行排空气法收集二氧化碳气体,则气体应从 (填b或c)口进入;
(7)下图是同学们在探究氧气性质实验中改进的实验装置图,简要回答甲、乙两个集气瓶中液体的作用 ,
。
实验室用石灰石(杂质既不溶于水也不与稀盐酸反应)和稀盐酸反应制取二氧化碳。(1)实验结束后,锥形瓶内已无气泡产生,但还有少量固体剩余。甲同学和乙同学对锥形瓶内溶液中溶质的成分展开辩论:甲说:因为瓶内有固体剩余,所以溶液中只有氯化钙(氯化钙溶液呈中性)而无盐酸。乙不完全同意甲的说法,请你说出乙的理由 。按乙的猜想,写出溶液中溶质成分的几种可能 (用化学式表示),请你选择其中一种情况,设计实验证明,完成下列探究报告:
| 猜想 |
实验步骤 |
实验现象及结论 |
| |
|
|
(2)丙同学为了测定石灰石中碳酸钙的质量分数,对一样品进行了如下定量实验:第一步:称取烧杯的质量为50.0g;第二步:将适量盐酸加入烧杯中并称重,烧杯和盐酸的总质量为100.0g;第三步:称取少量石灰石样品(质量为12.0g)加入烧杯中,使之与过量稀盐酸反应;第四步:待反应完全后,称重,烧杯和其中混合物的总质量为107.6g。
试通过分析计算:
① 该实验中生成的二氧化碳的物质的量是多少?
② 该石灰石样品中碳酸钙的质量分数是多少?(根据化学方程式列式计算,结果精确到0.1%)





 CO2
CO2 2MgO
2MgO 粤公网安备 44130202000953号
粤公网安备 44130202000953号