[江苏]2011-2012学年江苏省扬州市邗江区高二下学期期中考试化学试卷
汽车尾气无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g) 。下列说法错误的是
N2(g)+2CO2(g) 。下列说法错误的是
| A.升高温度可使该反应的正逆反应速率同时增大 |
| B.单位时间内消耗CO和NO的物质的量相等时,反应达到平衡 |
| C.反应达到平衡后,NO的反应速率保持恒定 |
| D.使用高效催化剂可增大反应速率 |
下列方法能使电离平衡H2O H+ + OH-向左移动的是
H+ + OH-向左移动的是
| A.向水中加入少量氢氧化钠固体 | B.向水中加入少量硫酸铝固体 |
| C.向水中加入少量碳酸钠固体 | D.将水加热到100℃,使水的pH=6 |
下列措施或事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.增大压强,有利于SO2与O2反应生成SO3 |
| C.加催化剂,使N2和H2在一定条件下转化为NH3 |
| D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的转化率 |
当反应2X+Y 2Z △H< 0达到平衡时,若升高温度则能使
2Z △H< 0达到平衡时,若升高温度则能使
| A.Z的质量分数增大 |
| B.X的转化率增大,Y的转化率减小 |
| C.X的转化率减小,Y的转化率增大 |
| D.Y的质量分数增大 |
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应 2A(气)+B(气) 2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是
2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是
| A.①④ | B.①③ | C.②③ | D.③④ |
0.1 mol·L-1的下列物质的水溶液中,氢离子浓度最大的是
| A.NH3·H2O | B.NH4Cl | C.HCl | D.HCOOH |
下列各组离子在指定的环境中一定能大量存在的是
| A.在pH=1的无色溶液中: K+、Na+、NO3- |
| B.在含碳酸钠的溶液中:NH4+、Fe3+、NO3- |
| C.在能使紫色石蕊试纸变蓝色的溶液中:Na+、Cu2+、S2- |
| D.由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:K+、Na+、OH- |
对达到平衡状态的可逆反应:A+B C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
A.A、B都是气体,C、D都不是气体
B..A、B都是气体,C、D有一种是气体
C.C、D都是气体,A、B都是气体
D.C、D都是气体,A、B有一种是气体
亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是
| A.亚硝酸不稳定,易分解 |
| B.0.1 mol·L-1的亚硝酸溶液的pH<7 |
| C.把pH=2的亚硝酸溶液稀释100倍后pH=3.5 |
| D.100 mL l mol·L-1的亚硝酸溶液恰好与100 mL l mol·L-1的NaOH溶液完全反应 |
常温下pH均为2的两种酸溶液X和Y各10 mL分别加水稀释到10000 mL,其pH与所加水的体积变化如图所示,下列结论中正确的是
| A.加水后,Y酸的电离度增大 |
| B.X酸在水溶液中存在电离平衡 |
| C.加水后,X酸的电离平衡常数减小 |
| D.X酸的物质的量浓度与Y酸的物质的量浓度相等 |
已知723 K时,2SO2(g)+O2(g)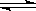 2SO3(g) ΔH=-Q,在相同条件下,向一密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出的热量为Q1;向另一体积相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2。则Q1、Q2、Q满足的关系是
2SO3(g) ΔH=-Q,在相同条件下,向一密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出的热量为Q1;向另一体积相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2。则Q1、Q2、Q满足的关系是
| A.Q=2Q2 | B.Q1=2Q2 |
| C.Q=Q1>Q2 | D.Q>Q1>Q2 |
在密闭容器中进行反应:M(g)+N(g) 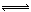 R(g)+2L,此反应符合下图关系,该反应是下列哪种情况
R(g)+2L,此反应符合下图关系,该反应是下列哪种情况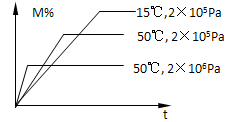
| A.正反应吸热,L是固体或液体 |
| B.正反应吸热,L是气体 |
| C.正反应放热,L是固体或液体 |
| D.正反应放热,L是气体 |
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)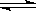 xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
| A.x=1 |
| B.B的转化率为80% |
| C.2 min内A的平均反应速率为0.3 mol·(L·min)-1 |
| D.若混合气体的密度不变则表明该反应达到平衡状态 |
向体积为Va的0.05 mol·L-1CH3COOH溶液中加入体积为Vb的0.05 mol·L-1KOH溶液,下列关系正确的是

A.Va=Vb时:c (CH3COO-)="c" (K+) |
B.Va=Vb时:c (CH3COOH) +c (H+)="c" (OH-) |
C.Va>Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+) |
D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-) |
常温下,0.1 mol·L-1某一元酸(HA)溶液中 =1×10-6,下列叙述正确的是
=1×10-6,下列叙述正确的是
A.加水稀释,溶液的c(OH-)增大
B.此时,HA的电离平衡常数约为10-8
C.溶液中水电离出的H+的物质的量浓度约为10-10 mol·L-1
D.与0.05 mol·L-1NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解。试回答下列问题:
(1)FeCl2溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以 (填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应 。
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是 。
| A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。 |
| B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。 |
| C.丙同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。 |
| D.丁同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。 |
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g) 3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。
3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。
请回答下列问题,
(1)该反应的焓变△H 0(填“>”、“<”或“=”)。
(2)30℃时,平衡混合气中C的体积分数ω= ,A物质的转化率与B物质的转化率之比为 。
(3)30℃时,若在同一容器中加入1.5 mol A、 mol B和1.5 mol C,则平衡混合气中C的体积分数仍为ω,此时平衡体系中A的物质的量浓度为 mol·L-1。
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1L溶液。
①溶液中浓度为0.01 mol·L-1的离子是 。
②物质的量之和为0.01 mol的两种粒子是 和 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 (填“碱性”、“酸性”或“中性”),醋酸体积 氢氧化钠溶液体积(填“>”、“<”或“=”)。
(3)将m mol·L-1的醋酸和n mol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7, m与n的大小关系是m n。(填“>”、“<”或“=”)
(4)浓度为0.100 mol·L-1的下列各物质的溶液中,c( )由大到小的顺序是
)由大到小的顺序是
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA- HA- H++A2-
H++A2-
已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度
0.11 mol·L-1(填“>”“=”或“<”)。
用一定物质的量浓度的NaOH溶液滴定10.00 mL已知浓度的盐酸,滴定结果如图所示。回答下列问题:
(1)有关滴定的操作可分解为如下几步,并补充完整。①用NaOH溶液润洗滴定管。②取NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL。③ ④调节液面至“0”或“0”刻度以下,记下读数。⑤移取10.00 mL盐酸注入锥形瓶中,加入酚酞。⑥把锥形瓶放在滴定管的下面,用氢氧化钠溶液滴定并记下读数。
(2)若滴定前俯视滴定管读数,滴定后平视刻度读数,则会使氢氧化钠浓度的测定结果 (填“偏高”“偏低”或“不变”)。
(3)如用酚酞作指示剂,则滴定终点的实验现象是 。
(4)c(HCl)= mol·L-1
(5)c(NaOH) = mol·L-1
(6)右图表示50 mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号) 。
| A.是a mL | B.是(50-a)mL |
| C.一定大于a mL | D.一定大于(50-a)mL |
(7)常温下,用0.01 mol•L-1H2SO4溶液滴定0.01 mol•L-1 NaOH溶液,中和后加水至100 ml。若滴定到终点时少加一滴H2SO4(设1滴为0.05 ml)。则此时溶液的pH为 。
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)  2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2,O2,SO3物质的量变化如图。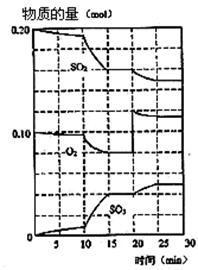
①该反应的化学平衡常数表达式 K=
②该反应能自发进行的原因是 。
③据图判断,该反应处于平衡状态的时间是 。
④据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。
(2)某化学研究学习小组用下图的装置组装设计了一个实验,以测定SO2转化为SO3的转化率,仪器的连接顺序是a→h→i→b→c→f→g→d→e。
①为提高SO2的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
②在Ⅰ处用大火加热烧瓶时SO2的转化率会 。(填“填大”“不变”或“减小”)
③用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为 。
CO2可转化成有机物实现碳循环。
(1)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从0 min到10 min,v(H2)= mol·(L·min)-1。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.将H2O(g)从体系中分离 B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1 mol CO2和3 mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实。
2CO2(g)+6H2(g) 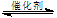 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在一定压强下,测得反应的实验数据如下表。
分析表中数据回答下列问题:
①反应的温度升高,K值 (填“增大”、“减小”或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”或“不变”)。
(3)800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)  CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号