[广西]2011-2012学年广西北海市合浦县教育局高一下学期期中化学试卷
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为
| A.57 | B.7 | C.61 | D.293 |
N的质量数为14,在微粒NH3中,电子数、质子数、中子数之比为
| A.10:7: 11 | B.10:11:9 |
| C.10:11:8 | D.10:10:7 |
下列化学变化中需加入氧化剂才能实现的是
| A.Fe→FeCl2 | B.SO3→H2SO4 |
| C.CO2→CO | D.KMnO4→MnCl2 |
0.012kg14C含有的碳原子数
| A.等于NA | B.小于NA |
| C.大于NA | D.无法判断 |
某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的核电荷数为
| A.11 | B.15 | C.17 | D.34 |
R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-变为RO42离子。又知反应中氧化剂与还原剂的物质的量之比为5:2。则n的值是
| A.1 | B.2 | C.3 | D.4 |
由极性键形成的非极性分子的是
| A.CO2P4 | B.NH3 | C.H2O | D.KCl |
主族元素在周期表中的位置取决于该元素原子的
| A.相对原子质量和核外电子数 |
| B.电子层数和最外层电子数 |
| C.相对原子质量和最外层电子数 |
| D.电子层数和次外层电子数 |
根据反应:2H2S+O2==2S↓+2H2O, 4NaI+O2+2H2SO4==2I2+2Na2SO4+2H2O,
Na2S+I2==2NaI+S↓ 判断下列物质的氧化性强弱,正确的是
| A.O2>I2>S | B.H2S>NaI>H2O |
| C.S>I2>O2 | D.H2O>NaI>H2S |
下列微粒中,跟NH4+的电子总数和质子总数都相同的是
| A.Ne | B.F- | C.CH4 | D.H3O+ |
下列反应中一定属于氧化还原反应的是
| A.化合反应 | B.分解反应 |
| C.置换反应 | D.复分解反应 |
下列说法中,正确的是
| A.失去电子是还原剂,具有氧化性 |
| B.氧化还原反应的本质是元素化合价的升降 |
| C.阳离子只有氧化性,阴离子只有还原性 |
| D.氧化还原反应中,某元素由化合态变为游离态,此可能被还原,也可能被氧化 |
简单原子的原子结构可用下图形象地表示:其中●表示质子或电子,o表示中子,则下列有关①②③的叙述正确的是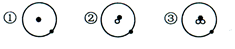
| A.①②③具有相同的质量数 |
| B.①②③为三种不同元素的原子 |
| C.①③互为同位素 |
| D.②③是二种化学性质完全不同的粒子 |
X元素原子的质量数为m,核内中子数为n,则wgx+含有电子的物质的量是
A. |
B. |
C.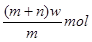 |
D.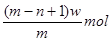 |
下列试剂的存放正确的是
| A.钾、钠在空气中极易氧化,与水发生剧烈反应,应放在盛有煤油的广口瓶中以隔绝空气 |
| B.盛放氢氧化钠溶液的瓶口用玻璃塞塞紧,不能用橡皮塞 |
| C.浓硝酸、硝酸银见光易分解,应存放在棕色细口瓶中,低温避光保存 |
| D.以上方法都不正确 |
在含有70克N2,128克O2和44克CO2的混和气体(标准状况)中,氮气所占体积百分比为
| A.29.3% | B.33.3% | C.36% | D.50% |
有 和
和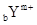 两种离子,其电子层结构相同。下列关系式或化学式正确的是
两种离子,其电子层结构相同。下列关系式或化学式正确的是
| A.a-n=b+m | B.氧化物为YOm |
| C.a+m=b-n | D.氢化物为HnX或XHn |
若NA表示阿伏加德罗常数,下列说法正确的是
| A.在同温同压时,相同体积的任何气体所含的原子数目相同 |
| B.将49g H2SO4溶于1L水中,所得溶液的物质的量浓度为0. 5mol·L-1 |
| C.标准状况下,11.2L水所含分子数为0.5 NA |
| D.18g NH4+含有的电子数为10NA |
在标准状况下有①6.72L CH4,②3.01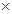 1023个HCl分子,③13.6gH2S,④0.2mol氨气。下列对这四种气体的关系从大到小描述不正确的是
1023个HCl分子,③13.6gH2S,④0.2mol氨气。下列对这四种气体的关系从大到小描述不正确的是
| A.体积:②>③>①>④ |
| B.氢原子数:①>④>③>② |
| C.质量:②>③>①>④ |
| D.密度:②>③>④>① |
制印刷电路时常用氯化铁作为腐蚀液,发生反应为2FeCl3+Cu=2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
| A.烧杯中有铜无铁 | B.烧杯中有铁无铜 |
| C.烧杯中铜,铁都有 | D.烧杯中铜铁都无 |
在元素周期表中周期表中共有_______个纵行,若每个纵行称作1列,则VA族是第____列。
ⅡA族后面是第_______族。所含元素的种类最多的是____________族; 同一周期,从左向右,原子半径逐渐_____________,金属性逐渐__________;
同一主族,从上到下,原子半径逐渐_____________,还原性逐渐__________;
同一元素的阴离子半径________相应的原子半径,电子层结构相同的离子,
核电荷数越多,半径越__________。
H、D、T的中子数分别是_________,质量数分别是_____________,
同位素原子的 虽然不同,但______________基本上完全相同;
16O、17O、18O属____________,O2、O3、O4属________________,
某元素的同位素原子可以形成3种分子量不同的双原子分子,
则该元素有_________种同位素原子。
常见的10电子微粒中,分子有:_____________________(只举一例,下同),
阳离子有_________________________,阴离子有_________________________;
常见的18电子微粒中,分子有__________________________,
阳离子有___________________________,阴离子有_________________________。
判断下列说法中是否正确:(请在空格内打“√”或“×”)
①质子数相同的粒子一定属于同种元素; ( )
②电子数相同的粒子不一定是同一种元素; ( )
③一种元素只能有一种质量数; ( )
④某种元素的相对原子质量取整数,就是其质量数; ( )
⑤质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子; ( )
⑥同位素的性质几乎完全相同 ( )
现有X、Y、Z、W四种短周期元素原子序数依次增大,其原子半径及主要化合价如下表所示。又知X与Y、Z与W分别位于同一周期,Y、W处于同一主族。
| 元素 |
X |
Y |
Z |
W |
| 原子半径/nm |
0.077 |
0.074 |
0.186 |
0.102 |
| 主要化合价 |
-4,+4 |
-2 |
+1 |
-2,+6 |
请回答: X位于元素周期表的 ,画出Z原子结构示意图 ,
Z2W是离子晶体,写出其电子式 。X单质能与某酸(H2WY4)的浓溶液发生反应,产物有XY2、WY2和水,
其反应的化学方程式为 ;Z2Y2可与XY2发生反应可给潜水艇供氧,其反应的化学方程式为 ;
若反应中转移电子数为3.01×1023,则所得气体产物的体积是 (标准状况)。Y、Z、W三种元素可组成质量比为5.75 : 8 : 4的某种化合物。实验室检验该化合物中所含阴离子的操作方法及有关实验现象是:取少量含该阴离子的溶液, ,则证明原溶液中含有该阴离子。
观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题: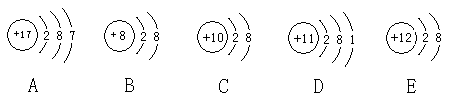
属于离子结构示意图的是 、 (填写微粒符号)。
五种粒子中,性质最稳定的原子是 (用微粒符号填写,在本小题中下同),最容易失去电子的原子是 ,最容易得到电子的原子是 。
A、E两种元素形成的化合物在水溶液中的电离方程式是 。
在核电荷数为1-18的元素中,写出两种与B核外电子层排布相同的离子,其离子的符号为 、 (A-E中已出现的元素除外)。
在一定条件下,D可以和氮气(N2)化合成一种白色物质,该物质的化学式是 。
将一定量的CO2气体通入500 mL某NaOH溶液中,充分反应后。将溶液在低温下蒸发。得到不含结晶水的白色固体A。取三份质量不同的该白色固体A分别与50 mL相同浓度的盐酸反应.得到气体的体积(标准状况)如下表所示。
| 组别 |
① |
② |
③ |
| 盐酸的体积mL |
50 |
50 |
50 |
| 固体A的质量g |
3.80 |
6.20 |
7.20 |
| 气体体积mL |
896 |
1344 |
1344 |
上表中第 组数据表明加入的50mL盐酸有剩余,其理由是?
通过计算讨论判断固体A是什么物质?其成分的质量分数是多少?
 粤公网安备 44130202000953号
粤公网安备 44130202000953号