[广西]2011-2012学年广西武鸣高中高二上学期段考化学(文)试卷
为了科学地饮食,了解一些与食品相关的化学知识是必要的。油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中最适宜充入的是
| A.氮气 | B.二氧化碳 | C.空气 | D.氧气 |
下列说法正确的是
| A.在加碘食盐中,碘以单质形式存在 |
B.纳米材料是指一种称为“纳米”的新 物质制成的材料 物质制成的材料 |
| C.光导纤维是以二氧化硅为主要原料制成的 |
| D.绿色食品是指不含任何化学物质的食品 |
下列关于过氧化钠的说法中,不正确的是
| A.能与水反应生成碱和氧气 | B.是强氧化剂 |
| C.是白色固体 | D.能与二氧化碳起反应生成盐和氧气 |
在同温同压下,相同体积的乙烯和氮气不同的是
| A.物质的量 | B.质量 | C.含有的分子数 | D.含有的原子数 |
下列反应中硫元素表现出氧化性的是
| A.稀硫酸与锌粒反应 | B.浓硫酸与铜反应 |
C.二氧化硫与氧气反应 |
D. 三氧化硫与水反应 三氧化硫与水反应 |
下列反应中,属于氧化还原反应的是
| A.HCl十NaOH=NaCl+H2O | B.2Na+2H2O=2NaOH+H2↑ |
| C.CO2+2NaOH=Na2CO3+H2O | D.CaCO3 CaO+CO2↑ CaO+CO2↑ |
下列物质的水溶液,pH大于7的是
| A.SO2 | B.NH3 | C.NH4Cl | D.Na2SO4 |
下列说法中,正确的是
| A.在周期表里,元素所在的周期数等于原子核外电子层数 |
| B.在周期表里,主族元素所在的族序数等于原子核外电子数 |
C.最外层电子数为8的粒子是稀有气 体元素的原子 体元素的原子 |
| D.元素的原子序数越大,其原子半径也越大 |
设NA为阿伏加德罗常数,下列说法中不正确的是
| A.2.3g金属钠变为钠离子时失去的电子数是0.1NA |
| B.0.5NA个氯分子所占体积约为11.2L |
| C.32g氧气所含原子数为2NA |
| D.18g水所含的质子总数为10NA |
只用一种试剂,能将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是
| A.NaOH溶液 | B.AgNO3溶液 | C.Ba(OH)2溶液 | D.BaCl2溶液 |
在下列反应的离子方程式中,正确的是
A.二氧化硫与水反应:SO2 + H2O = 2H+ + SO32- 2H+ + SO32- |
| B.碳酸钙溶液与盐酸反应: CO32- +2H+ = CO2↑+ H2O |
| C.铁与稀硫酸反应:Fe + 2H+ =Fe2+ + H2↑ |
| D.硫酸铜溶液与氢氧化钡溶液反应: SO42-+Ba2+ = BaSO4↓ |
下列关于碳和硅的叙述中,正确的是
| A.单质在加热时都能跟氧气反应 | B.氧化物都能溶于水生成相应的酸 |
| C.单质在常温下化学性质都活泼 | D.氧化物都能与氢氧化钠溶液反应 |
下列关于F、Cl、Br、I的比较中,不正确的是
| A.它们的原子核外电子层数随原子序数的增加而增多 |
| B.被其它卤素单质从卤化物中置换出来的可能性随原子序数的增加而增大 |
| C.它们的氢化物的稳定性随原子序数的增加而增强 |
| D.它们的单质颜色随原子序数的增加而加深 |
下列各组物质中,常温下能起反应产生气体的是
| A.铁跟浓硫酸 | B.铝跟浓硫酸 | C.铜跟稀盐酸 | D.铜跟浓硝酸 |
在下列反应中,能置换出铁的是
| A.Cu + FeCl2(溶液) | B.Na + FeSO4(溶液) |
| C.Ag + FeSO4(溶液) | D.Al +Fe3O4(高温) |
A、B、C都是金属,把A放入C盐溶液时,A的表面附着一层C;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为
A.A>B>C B.B>A>C C.A>C>B D.B>C>A
反应N2(g) + 3H2(g)  2NH3(g),如果2min内N2的浓度由6mol/L减小到2mol/L,那么用N2浓度变化来表示的该反应在这2min内的反应速率为
2NH3(g),如果2min内N2的浓度由6mol/L减小到2mol/L,那么用N2浓度变化来表示的该反应在这2min内的反应速率为
| A.4 mol/L | B.2mol/(L·min) | C.6 mol/(L·min) | D.3mol/(L·min) |
下列说法中正确的是
| A.可逆反应的特征是反应物和生成物的浓度相等 |
| B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动 |
| C.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态 |
| D.在其他条件不变时,增大压强一定会破坏有气体存在的反应的平衡状态 |
下列反应中,有沉淀产生且不会消失的是
| A.将CO2通入澄清石灰水溶液中,直至过量 |
| B.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量 |
| C.向AlCl3溶液中逐滴滴入稀硫酸 |
| D.向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量 |
X、Y、Z、W四种短周期元素在周期表中的位置如右图所示。已知这四种元素原子的核电荷数之和为36。则这四种元素按X、Y、Z、W顺序依次是
| W |
X |
Z |
| |
Y |
|
A. N、P、O、C B. C、N、O、P
C. O、S、N、F D. C、Si、Al、N
下列关于乙烯和乙炔的说法中,正确的是
| A.分子式相同 | B.互为同系物 | C.都属于不饱和烃 | D.互为同分异构体 |
下列各组物质不属于同素异形体的是
| A.H2O和H2O2 | B.O2和O3 | C.金刚石和石墨 | D.红磷和白磷 |
氟、氯、溴、碘的单质中,与氢气混合后在暗处就能发生剧烈反应的是(填写化学式,下同) ;常温下为深红棕色液体的是 ;能使淀粉溶液变蓝的是 。
浓硫酸敞口放置在空气中浓度会变稀这是因为浓硫酸具有 性;浓硝酸敞口放置在空气中浓度会变稀是因为浓硝酸具有 性;金属镁与稀硝酸反应主要不生成氢气,是因为稀硝酸具有
性;在浓硫酸存在下,浓硝酸与苯反应生成硝基苯,该 反应类型属于 反应。
反应类型属于 反应。
分别用一种试剂除去下列各物质中所含的少量杂质(括号内为杂质),在横线上填写需要加入的试剂:
(1)NaCl(Na2SO4): ;(2)KCl(K2CO3):  ;
;
(3)CO2(H2O): ;
氢氧化铝既可以与酸反应又可以与碱反应,是典型的两性氢氧化物。氢氧化铝和盐酸反应的化学方程式为 ;和NaOH溶液反应的化学方程式为 。
有A、B、C三种物质,它们的分子中都含有14个电子,其中A是由双原子分子组成的单质,B仅由碳、氢两种元素组成,C的分子由碳、氧两种原子构成。
根据以上叙述填写下列空白:
(1)A的电子式为 ;(2)B的结构式为 ;
(3)C的分子式为 ;
(4)A与H2在一定条件下可化合生成一种化合物,该化合物的名称是 。
A、 B、C、D四种短周期元素,它们的核电荷数依次增大;A元素原子核外只有一个电子;C元素的焰色反应呈黄色;B元素原子L层电子数是K层电子数的3倍;D原子核中的质子数比C多6个。
B、C、D四种短周期元素,它们的核电荷数依次增大;A元素原子核外只有一个电子;C元素的焰色反应呈黄色;B元素原子L层电子数是K层电子数的3倍;D原子核中的质子数比C多6个。
回答:
⑴.A是 ,B是 。
⑵.C元素最高价氧化物对应水化物的化学式为 。
⑶C和D形成的化合物的化学键类型为 。(填“离子键”或“共价键”)
⑷.D元素在周期表中的位置是第 周期第 族。
有四种钠的化合物W、X、Y、Z,根据下列反应式判断W、X、Y、Z的化学式。
① W →X + CO2↑ +H2O ② Z + CO2→ X + 02
③  Z+ H2O → Y + 02↑ ④ X + Ca(OH)2→ Y + CaCO3↓
Z+ H2O → Y + 02↑ ④ X + Ca(OH)2→ Y + CaCO3↓
W ;X ;Y ;Z 。
实验室制取乙烯的装置如右图所示,请根据图 示回答下列问题:
示回答下列问题:
(1)在烧瓶中放入 酒精和浓硫酸(体积比约为
酒精和浓硫酸(体积比约为
1∶3)的混合液,为避免混合液暴沸,常放入少量 。加热混合液使液体温度迅速升到 时就有乙烯生成。
(2)实验室制乙烯的化学方程式是:
。在这个反应中,浓硫酸所起到的作用是 。
将13.44L(标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了5.6g。求原气体混合物中乙烯与乙烷的物质的量之比。
 98
98 、K+
、K+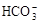 、Na+
、Na+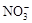 、Cl-、K+
、Cl-、K+ 极性键
极性键 粤公网安备 44130202000953号
粤公网安备 44130202000953号