2022年宁夏中考化学试卷
下列实验操作正确的是( )
|
|
|
|
|
|
A |
B |
C |
D |
| A. |
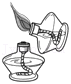
点燃酒精灯 |
B. |
倾倒液体 |
| C. |
往试管里装入固体粉末 |
D. |
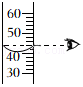
读取量筒内液体的体积 |
分类法在科学研究中具有广泛的应用。下列对物质分类正确的是( )
| A. |
纯碱、烧碱都属于碱 |
| B. |
黄铜、氧化铜都属于金属材料 |
| C. |
一氧化碳、酒精都属于有机物 |
| D. |
硝酸钾、磷酸二氢铵都属于复合肥料 |
对下列生活中的做法或现象,解释错误的是( )
|
选项 |
做法或现象 |
解释 |
|
A |
自行车车架表面刷漆 |
隔绝空气和水,防止锈蚀 |
|
B |
把硬水煮沸,降低硬度 |
水中的可溶性钙、镁化合物生成沉淀,使水软化 |
|
C |
喝了汽水以后,常常会打嗝 |
气体的溶解度随温度升高而减小 |
|
D |
滴加洗涤剂的水能将餐具上的油污洗掉 |
洗涤剂对油污具有溶解作用 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下列对有关主题知识的归纳有错误的是( )
|
A |
化学与健康 |
B |
化学与农业生产 |
|
①长期饮用蒸馏水不利于人体健康 ②霉变的大米煮熟后可以正常食用 |
①农药要科学、少量、精准使用 ②铵态氮肥不能与碱性物质混用 |
||
|
C |
化学发展史 |
D |
化学与环境保护 |
|
①原子论和分子学说的创立,奠定了近代化学的基础 ②门捷列夫发现了元素周期律,并编制出元素周期表 |
①美丽中国离不开化学 ②“绿色化学”是环境友好化学 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
结合下列图示或符号,有关说法正确的是( )
|
|
|
|
|
|
A |
B |
C |
D |
| A. |
表示两个氢元素 |
| B. |
该粒子是阳离子 |
| C. |
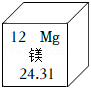
镁原子的相对原子质量是24.31 |
| D. |
氧化铝中铝元素的化合价为+2 |
长时间剧烈运动,人体内会产生乳酸(化学式 ),使肌肉产生酸痛感。下列关于乳酸的说法正确的是( )
| A. |
乳酸的相对分子质量为90g |
| B. |
乳酸中碳元素的质量分数为40% |
| C. |
乳酸由碳原子、氢原子、氧原子构成 |
| D. |
乳酸中碳、氢、氧元素的质量比为 |
粗盐中难溶性杂质的去除实验涉及到称量、溶解、过滤、蒸发等操作。下列操作正确的是( )
| A. |
蒸发时,将滤液蒸干后停止加热 |
| B. |
溶解时,振荡烧杯加速粗盐的溶解 |
| C. |
过滤时,将玻璃棒靠在三层滤纸一边 |
| D. |
称量时,将粗盐直接放在天平的左盘上 |
下列对宏观性质或现象的微观解释正确的是( )
| A. |
钠元素和镁元素存在本质区别,因为钠原子和镁原子的质量不同 |
| B. |
盐酸和硫酸化学性质相似,因为它们的溶液中都含有氢氧根离子 |
| C. |
金刚石和石墨物理性质差异大,因为构成它们的碳原子结构不同 |
| D. |
品红在热水中比在冷水中扩散更快,因为在受热情况下分子能量增大,运动速率加快 |
除去下列各组物质中的杂质,所选用的药品或方法正确的是( )
|
选项 |
物质 |
杂质 |
选用的药品或方法 |
|
A |
氧气 |
水蒸气 |
浓硫酸 |
|
B |
氧化钙 |
碳酸钙 |
稀盐酸 |
|
C |
二氧化碳 |
一氧化碳 |
点燃 |
|
D |
氯化亚铁溶液 |
氯化铜 |
锌粒 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下列实验设计能达到实验目的的是( )
|
选项 |
A |
B |
C |
D |
|
实验 目的 |
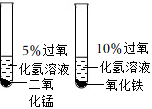
比较二氧化锰和氧化铁对过氧 化氢分解反应的催化效果 |
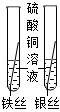
比较铁、铜、银三种 金属的活动性顺序 |
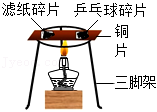
探究可燃物燃烧与 氧气有关 |
验证质量守恒定律 |
|
实验 设计 |
|
|
|
|
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
2022年2月4日至20日,北京成功举办第24届冬季奥运会。
(1)本届冬奥会的吉祥物“冰墩墩”的冰晶外壳由塑料制成,该外壳材料属于 (写“复合材料”或“合成材料”)。
(2)本届冬奥会期间提供的各种具有中国特色的美食,受到各国运动员的欢迎,尤其以烤鸭、牛肉水饺更受青睐。这两种美食中都富含的营养素是 (写一种)。
(3)“低碳”是本届冬奥会的主题,其速滑馆“冰丝带”采用了当前最环保的技术——二氧化碳跨临界直冷制冰技术。该技术的过程之一,就是通过压力将二氧化碳由气态直接转化为固态。这个过程从微观角度看,未发生改变的是 。
学会从图表中获取关键信息是化学学习的基本能力。根据图﹣﹣氯化钠和硝酸钾的溶解度曲线,回答下列问题。
(1)图中P点表示的含义是 。
(2)在保持一定温度的条件下,将硝酸钾的不饱和溶液转化为饱和溶液,可采用的方法有 (写一种)。
(3)40℃时,将硝酸钾和氯化钠的饱和溶液同时降低温度到10℃,此时两种溶液中溶质的质量分数的大小关系是:硝酸钾 氯化钠。
(4)若接近饱和的氯化钠溶液中混有少量的硝酸钾,可采用 的方法得到较纯净的氯化钠晶体。

学习制取几种常见的气体并探究其性质,是初中阶段化学学习的重要内容。
(1)图1是实验室制取气体的一些装置图。写一个用A装置制取某气体的化学方程式 。如果将B装置与 (写序号)装置连接,可以制取二氧化碳。

(2)依照图2所示实验,可得出以下结论:
①根据蜡烛熄灭的现象,说明二氧化碳不支持燃烧;
②根据 的现象,说明二氧化碳不具有可燃性;
③根据 的现象,说明二氧化碳的密度比空气的密度大。
上世纪50年代,我国在A市探明铁矿藏(主要成分 )储量巨大。为将铁矿石变成钢铁,国家建设冶炼工厂,运入大量煤炭,用作冶炼钢铁原料、火力发电和生活燃料。源源不断的钢铁从这里运出支持国家建设,但是随着持续大量使用煤炭,生态环境也日趋脆弱,甚至恶化。
进入新时代,A市政府秉持“绿水青山就是金山银山”的发展理念,落实“碳达峰、碳中和”的发展目标,重新审视发展模式。A市地处高原,每年刮风和日照时间较长;附近拥有数条河流和许多湖泊,水资源比较丰富。于是A市政府确定,围绕钢铁工业,大力发展“绿色”电能,用电生产氢气,用氢气取代煤炭,走“绿色低碳”经济发展道路。
结合上述材料回答下列问题:
(1)将煤隔绝空气加强热可得到焦炭,焦炭能够用于冶炼铁,说明焦炭具有 性。
(2)根据地方资源特色,A市规划发展“绿色”电能,首先应当重点将 (写一种)转化为电能;然后利用电生产氢气。利用电生产氢气的化学方程式是 。
(3)氢气的化学性质和一氧化碳有许多相似之处。写出用氢气与氧化铁在高温条件下反应,冶炼铁的化学方程式 。A市将氢气用于冶炼钢铁和生活燃料,所排放的废弃产物都是 ,对环境影响很小。
硫酸亚铁在工农业生产中有重要用途,也有较高的医用价值。某工厂用铁屑和稀硫酸反应生产硫酸亚铁。将50kg质量分数为19.6%的稀硫酸跟足量的铁屑反应。
(1)试计算生成硫酸亚铁的质量。
(2)人体铁元素摄入不足会引起 。
氢氧化钠溶液与稀硫酸反应,没有明显现象。同学们针对氢氧化钠与硫酸是否发生反应展开探究。【猜想与假设】甲同学:两种物质混合,有两种可能。
(1)不发生反应,仅仅是简单混合;
(2)发生反应,反应物减少或消失。
【设计与实验一】取少量稀硫酸于试管中,滴入2滴酚酞溶液,然后向试管中又滴加2滴氢氧化钠溶液。试管内无明显现象产生。
实验结论:氢氧化钠与硫酸发生反应。
【解释与结论一】如果氢氧化钠不与硫酸反应,一定是简单混合,那么溶液一定会呈现 ,但是这样的现象并未出现,说明试管内 ,即氢氧化钠与硫酸发生反应。
【设计与实验二】乙同学受到启发。取少量稀硫酸于试管中,用pH试纸测得试管内溶液的pH为a;然后向试管内滴加3滴氢氧化钠溶液(如图),振荡,又用pH试纸测得pH为b;继续向试管内滴加3滴氢氧化钠溶液,振荡,再用pH试纸测得pH为c。
【解释与结论二】三次测得的pH由大到小的顺序是 。随着氢氧化钠溶液的不断滴加,试管内溶液的 性在逐渐减弱。
【设计与实验三】继续向上述试管内滴加氢氧化钠溶液,当pH大于7时,试管内 ,证明氢氧化钠与硫酸发生反应。
【表达与交流】甲、乙同学所做实验中涉及反应的化学方程式是 ,该反应的基本反应类型属于 。

某地区有盐碱地分布,化学兴趣小组针对盐碱地成分展开探究。
【猜想与假设】在老师的指导下,同学们认为盐碱地土壤中可能含有:
①碳酸钠②碳酸氢钠③氢氧化钠
【查阅资料】
(1)碳酸氢钠受热容易分解,生成碳酸钠、水和二氧化碳;
(2)氯化钙溶液呈中性;
(3)碳酸氢钙可溶于水。
【设计与实验一】甲同学取少量盐碱地土壤于烧杯中,加入适量的蒸馏水,充分搅拌混合后过滤,将所得滤液分成三等份,依次编号为1号、2号和3号,进行如下实验。
|
实验步骤 |
实验现象 |
实验结论 |
|
取1号滤液滴加足量稀盐酸 |
﹣﹣﹣ |
滤液里可能含有碳酸钠,也可能含有碳酸氢钠 |
|
取2号滤液滴加 溶液 |
|
滤液里一定含有碳酸钠。 相关化学方程式是 |
实验结论:盐碱地土壤中含有碳酸钠。
【设计与实验二】乙同学设计如图所示装置并实验。
实验结论:盐碱地土壤中不含碳酸氢钠。得出该结论所依据的实验现象是 。
【设计与实验三】丙同学设计实验如下。
|
实验步骤 |
实验现象 |
实验结论 |
|
取3号滤液 |
|
盐碱地土壤中不含氢氧化钠 |
【反思与交流】丁同学经过思考,认为盐碱地土壤长期暴露在空气中不可能含有氢氧化钠,他的理由是
(用化学方程式表示)。





 粤公网安备 44130202000953号
粤公网安备 44130202000953号