2022年湖北省荆州市中考化学试卷
分类法是学习化学的基本方法。下列物质所属类别正确的是( )
| A. |
干冰—氧化物 |
B. |
糖水—化合物 |
| C. |
空气—纯净物 |
D. |
纯碱—碱 |
坚持生态优先、绿色发展理念,建设美丽荆州。下列举措不正确的是( )
| A. |
天更蓝—使用清洁能源 |
B. |
地更净—垃圾分类回收 |
| C. |
水更清—污水直排长江 |
D. |
景更美—城市绿化美化 |
6000L氧气在加压情况下可装入40L的钢瓶中。从分子角度解释合理的是( )
| A. |
氧分子体积变小 |
B. |
氧分子质量变小 |
| C. |
氧分子间隔变小 |
D. |
氧分子数目变少 |
下列关于酒精灯的说法不正确的是( )
| A. |
用火柴点酒精灯,使温度达到酒精着火点 |
| B. |
可向燃着的酒精灯里添加酒精 |
| C. |
酒精灯外焰燃烧最充分,温度最高 |
| D. |
用灯帽盖灭酒精灯,使酒精和空气隔绝 |
水是生命之源,下列有关水的说法正确的是( )
| A. |
地球上可利用的淡水资源取之不尽、用之不竭 |
| B. |
保持水的化学性质的最小粒子是氢原子和氧原子 |
| C. |
硬水中含有较多钙、镁化合物,提倡多喝硬水 |
| D. |
水能溶解很多物质,是一种最常见的溶剂 |
甲醛( )的水溶液俗称福尔马林,可用于浸泡动物标本。下列说法不正确的是( )
| A. |
甲醛由碳、氢、氧三种元素组成 |
| B. |
一个甲醛分子由一个碳原子和一个水分子构成 |
| C. |
甲醛分子中碳、氢原子个数比为1:2 |
| D. |
不同质量分数的甲醛水溶液中氢、氧元素的质量比均为1:8 |
推理是化学学习中常用的思维方法。下列推理正确的是( )
| A. |
单质是由一种元素组成的纯净物,所以由一种元素组成的纯净物一定是单质 |
| B. |
有机物都含有碳元素,所以含有碳元素的化合物一定是有机物 |
| C. |
置换反应生成单质和化合物,所以生成单质和化合物的反应一定是置换反应 |
| D. |
燃烧都伴随着发光、放热现象,所以有发光、放热现象的一定是燃烧 |
下列实验方案,能达到实验目的的是( )
实验目的 |
实验方案 |
|
A |
检验集气瓶中 是否收集满 |
将带火星的木条伸入集气瓶内 |
B |
除去KCl溶液中混有的 |
滴加适量 溶液后过滤 |
C |
鉴别 、 两种无色气体 |
点燃气体,分别在火焰上方罩一个干燥的冷烧杯 |
D |
鉴别稀盐酸和蒸馏水 |
取样,分别滴加紫色石蕊溶液 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
如图是氮元素的化合价与物质类别的关系图,已知a物质是 ,下列叙述不正确的是( )
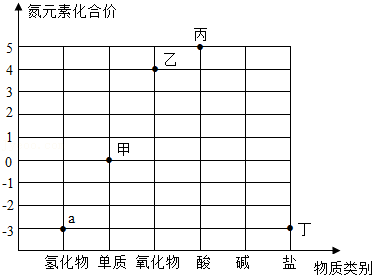
A.甲物质是空气中含量最多的物质
B.乙物质排放到空气中可能形成酸雨
C.丙物质的化学式为
D.丁物质中含有的阳离子是
化学使世界变得绚丽多彩。请回答:
(1)高铁电网通过石墨电刷给动车供电,因为石墨具有良好的 性。
(2)煤、石油和天然气都是 (填“可再生”或“不可再生”)能源。
(3)合理施用化肥有利于粮食增产,让“中国人的饭碗端在中国人手中”。下列可以作为复合肥的是 (填标号)。
| A. |
|
| B. |
|
| C. |
|
(4)北京冬奥会的吉祥物“冰墩墩”的冰晶外壳由塑料制成,塑料属于 (填标号)。
| A. |
金属材料 |
| B. |
天然材料 |
| C. |
合成材料 |
请用化学用语填空:
(1)铁锅容易生锈的主要原因是铁与空气中的 、水蒸气发生了化学反应。
(2)荆州熊家冢曾出土过表面有一层“铜绿”的青铜器,研究人员将“铜绿”隔绝空气加热,发现它分解生成了氧化铜、水和二氧化碳,由此得出组成“铜绿”的元素有 (填元素符号)。
(3)明代宋应星所著的《天工开物》里记载了我国古代冶金工艺。在炼铁反应
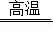 中具有还原性的反应物是 。
中具有还原性的反应物是 。
(4)科研人员利用催化剂,将两种温室气体进行转化,为“碳中和”提供了一种新的途径。其反应原理如图所示。
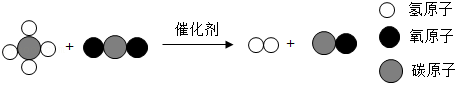
该反应的化学方程式为: 。
如图为铕(Eu)元素在元素周期表中的信息以及氧和氯的原子结构示意图。请回答:
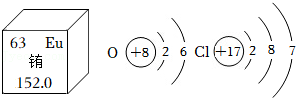
(1)铕是一种重要的稀土资源,它属于 (填“金属”或“非金属”)元素。
(2)铕原子中核外电子数为 。
(3)氧元素和氯元素最本质的区别是 不同。
(4)已知氯化铕的化学式为 ,则相同价态的铕的氧化物的化学式为 。
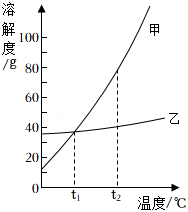
以下是 和NaCl在不同温度时的溶解度及对应的溶解度曲线。请回答:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
|
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
|
(1)代表 溶解度曲线的是 (填“甲”或“乙”)。
(2)若 中混有少量NaCl,可采用 的方法提纯 。
(3) 的范围为 (填标号)。
| A. |
10~20 |
| B. |
20~30 |
| C. |
30~40 |
| D. |
50~60 |
(4) 时,将等质量的 的饱和溶液和NaCl的饱和溶液分别降温到 ,所得溶液中溶质的质量 (填“>”或“<”或“=”)。
从废旧电脑的某些零部件中回收金属银,设计流程如图所示:
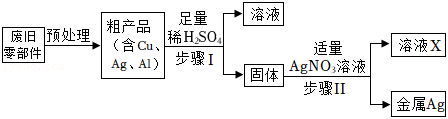
(1)步骤Ⅰ和步骤Ⅱ都涉及的实验操作是 。
(2)步骤Ⅰ中加入足量稀硫酸后发生反应的化学方程式为 。
(3)溶液X中只含有一种溶质,该溶质的化学式为 。
(4)据此判断,铜、银、铝的金属活动性由强到弱的顺序是 (填元素符号)。
实验室配制50g质量分数为6%的NaCl溶液,配制过程包括如下操作。请回答:

(1)图中使用到的玻璃仪器有 、量筒、玻璃棒、广口瓶四种。
(2)溶解时用玻璃棒搅拌的目的是 。
(3)该实验中量取的水的体积应为 mL。(水的密度为 )
(4)图示中正确的操作顺序为 (填标号)。
| A. |
④②⑤①③ |
| B. |
①②③④⑤ |
| C. |
①②④③⑤ |
| D. |
④⑤②③① |
“天宫课堂”上航天员做的泡腾片实验,让同学们再次感受到化学的魅力。泡腾片中含有碳酸钠或碳酸氢钠等物质,化学兴趣小组决定对它们的某些性质进行探究。
实验一:探究碳酸钠和碳酸氢钠溶液的酸碱度
【实验探究1】用pH试纸测得等浓度的碳酸氢钠溶液的pH为9,碳酸钠溶液的pH为11。
【实验结论1】两者均显碱性,且溶液碱性较强的是 。
实验二:探究碳酸钠和盐酸的反应
【实验探究2】向盛有碳酸钠溶液的烧杯中,逐滴加入一定浓度的稀盐酸并充分搅拌,测得pH变化与时间的关系如图1所示。观察到ab段无气泡产生,从b点开始产生气泡。经测定b点溶质只有碳酸氢钠和氯化钠,c点pH为7。
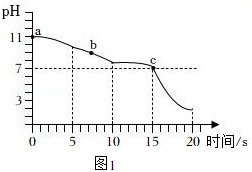
【实验结论2】碳酸钠和盐酸的反应是分两步发生的,ab段发生反应的化学方程式为 ,c点溶液中的溶质为 。
实验三:探究碳酸钠和碳酸氢钠的热稳定性
【查阅资料】①碳酸氢钠受热分解成碳酸钠、水和二氧化碳;②碳酸钠受热不分解。
【实验验证】取一定量的碳酸氢钠放入试管中加热,如图2所示。
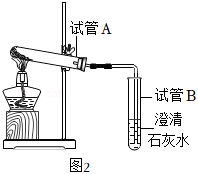
【交流反思】试管A管口向下倾斜的原因是 ,试管B中出现 现象,证明有二氧化碳生成。
【实验结论3】碳酸钠的热稳定性强于碳酸氢钠。
【拓展应用】溶洞内钟乳石的形成原理与碳酸氢钠受热分解相似﹣﹣溶有碳酸氢钙[ ]的地下水,遇热或当压强突然变小时,碳酸氢钙会分解成碳酸钙沉积下来,天长日久就形成了千姿百态的钟乳石。请写出碳酸氢钙分解的化学方程式 。
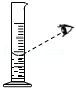 读数偏小
读数偏小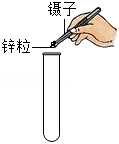 试管破裂
试管破裂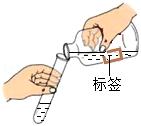 标签受损
标签受损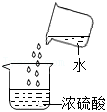 液滴飞溅
液滴飞溅
 粤公网安备 44130202000953号
粤公网安备 44130202000953号