2016年山东省潍坊市中考化学试卷
钛具有硬度大、密度小、熔点高、抗腐蚀性强等优良性能,被誉为"未来金属"、二氧化钛(TiO 2)中氧元素为﹣2价,则钛元素的化合价为( )
| A. |
+1 |
B. |
+2 |
C. |
+3 |
D. |
+4 |
下列说法错误的是( )
| A. |
原子核由质子、中子构成 |
B. |
花香四溢主要是分子之间有间隔 |
| C. |
保持水化学性质的微粒是水分子 |
D. |
化学反应前后原子的种类不会改变 |
下列说法错误的是( )
| A. |
氮气的化学性质稳定可作保护气 |
| B. |
购物时使用棉布袋有利于减少"白色污染" |
| C. |
工业上用汽油或烧碱溶液等清洗油污 |
| D. |
厨房内燃气泄漏时应立即打开排气扇 |
下列化学用语书写错误的是( )
| A. |
硫酸根离子:SO 4 2﹣ |
B. |
铁的元素符号:Fe 3+ |
| C. |
碳酸的化学式:H 2CO 3 |
D. |
3个二氧化硫分子:3SO 2 |
2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素(化学式C 15H 22O 5),是一 种治疗疟疾的特效药、下列说法错误的是( )
| A. |
青蒿素属于有机物 |
B. |
青蒿素的相对分子质量是282 |
| C. |
青蒿素由42个原子构成 |
D. |
青蒿素中碳、氢元素的质量比为90:11 |
下列有关实验操作"先"与"后"的说法中正确的是( )
| A. |
测定溶液的pH,先将试纸用水湿润,后用干净的玻璃棒蘸取待测液点在试纸上 |
| B. |
加热氯酸钾制取氧气时,用排水法收集气体;实验完毕后,先熄灭酒精灯,后将导管从水槽中移出 |
| C. |
一氧化碳还原氧化铁时,先加热氧化铁粉末至红热,后通入一氧化碳气体 |
| D. |
稀释浓硫酸时,先在烧杯中倒入水,后将浓硫酸沿烧杯壁缓慢地注入水中,并不断搅拌 |
"人造空气"帮助人类实现了"太空漫步"的梦想,按体积计算,其中含有70%的N 2、20%以上的O 2、还有CO 2.下列说法错误的是( )
| A. |
空气是一种宝贵的资源 |
| B. |
氧气可用作火箭发射的燃料 |
| C. |
相比空气,"人造空气"中的氮气含量低 |
| D. |
燃烧和缓慢氧化都属于氧化反应 |
元素化合价发生改变的反应都是氧化还原反应.例如:2  +
+ 
 2
2 
 ,反应前后,Fe和Cl元素的化合价发生了改变,该反应是氧化还原反应.下列判断错误的是( )
,反应前后,Fe和Cl元素的化合价发生了改变,该反应是氧化还原反应.下列判断错误的是( )
| A. |
分解反应都属于氧化还原反应 |
| B. |
置换反应都属于氧化还原反应 |
| C. |
复分解反应都不属于氧化还原反应 |
| D. |
有单质参加的化合反应属于氧化还原反应 |
除去如表各组物质中的杂质,所用试剂和方法不可行的是( )
选项 |
物质 |
杂质 |
除杂所用试剂和方法 |
A |
O 2 |
水蒸气 |
通过盛有生石灰的干燥管 |
B |
CaO粉末 |
CaCO 3 |
高温煅烧 |
C |
NaOH溶液 |
Ca(OH) 2 |
加入过量的Na 2CO 3溶液,过滤 |
D |
CuSO 4溶液 |
硫酸 |
加入过量CuO粉末,加热,充分反应后过滤 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
分类法在科学研究中具有广泛的应用.下列说法正确的是( )
| A. |
铝、银均属于金属单质,它们都能与稀硫酸反应 |
| B. |
金刚石和石墨都是由碳元素组成的单质,它们的原子排列方式相同 |
| C. |
硫酸铵、氯化铵均属于铵盐,它们都不能跟碱性肥料混合使用 |
| D. |
一氧化碳、三氧化硫均属于非金属氧化物,它们都能与氢氧化钠溶液反应 |
图A为镁原子的结构示意图,图B为镁元素在元素周期表中的部分信息.下列叙述错误的是( )

| A. |
镁离子核外有两个电子层 |
| B. |
镁原子在化学反应中易失去电子 |
| C. |
镁元素的原子序数等于镁元素原子的核内质子数 |
| D. |
由于元素原子的核外电子层数与元素所在的周期数相同,可知镁元素位于第2周期 |
如图所示,烧瓶内盛有x气体,若挤压滴管的胶头a,使液体y进入烧瓶中,振荡烧瓶,并倒放在铁架台上,将导管伸入滴有z的水中,打开弹簧夹b,可见烧杯中的液体如喷泉一样喷入烧瓶中,并出现颜色的改变。则x、y、z可能是( )
选项 |
x |
y |
z |
A |
O 2 |
H 2SO 4 |
紫色石蕊试液 |
B |
CO 2 |
H 2O |
无色酚酞试液 |
C |
CO |
Ca(OH) 2 |
紫色石蕊试液 |
D |
CO 2 |
NaOH |
无色酚酞试液 |

| A. |
A |
B. |
B |
C. |
C |
D. |
D |
如图对应关系正确的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
甲、乙、丙三种固体物质的溶解度曲线如图所示,下列分析错误的是( )

| A. |
t 1℃时,甲、乙、丙三种物质的溶解度大小关系是 丙>乙>甲 |
| B. |
含有甲、乙、丙三种物质的混合溶液恒温蒸发时首先析出乙,说明在此温度下乙的溶解度最小 |
| C. |
将t 3℃时,甲、乙、丙三种物质的饱和溶液降温至t 2℃,所得溶液的质量分数关系是丙>甲=乙 |
| D. |
若固体甲中混有少量乙,可采用降温结晶法提纯甲 |
化学就在我们身边,化学与生活息息相关.
(1)如表为某食品包装袋的部分说明:
商品名称 |
××饼干 |
配料 |
小麦粉、白砂糖、精炼植物油、鸡蛋、食盐、食品添加剂(碳酸氢铵、碳酸氢钠、柠檬酸等) |
规格 |
180g |
保持期 |
10个月 |
请回答下列问题:
①在饼干的配料中,富含蛋白质的是
②碳酸氢钠的俗称 ;在医疗上,它是治疗 症的一种药剂.
③考虑到营养均衡,把榨好的蔬菜汁放在面粉中和面,做成口味独特、营养丰富的蔬菜馒头,这种馒头提供的主要营养素是糖类和 .
(2)饮用硬度过大的水不利于人体健康,日常生活中常用 来区分硬水和软水,可用 的方法降低水的硬度.
(3)交警通过酒精检测仪显示的颜色变化,可快速检测出司机是否酒后驾车,其反应原理为2CrO 3(红色)+3C 2H 5OH+3H 2SO 4═Cr 2(SO 4) 3(绿色)+3CH 3CHO+6X,X的化学式为 .
治理污染、保护环境,事关人民群众的身体健康和社会的可持续发展。
(1)下列环境问题与燃煤有直接关系的是 (填序号)。
A.酸雨 B.温室效应 C.可吸入颗粒物增加
(2)烟气脱硫是目前控制燃煤的重要途径。如钠碱循环法是利用亚硫酸钠(Na 2SO 3)溶液脱除烟气中的SO 2,生成亚硫酸氢钠(NaHSO 3),反应的化学方程式为 ,Na 2SO 3可由NaOH溶液吸收SO 2制得,反应的化学方程式为 。
(3)大气中CO 2含量不断升高,使全球气候问题日趋严重。科学家们正在努力尝试通过多种途径减少CO 2的排放或将CO 2转化为有用物质。

①途径一:利用NaOH溶液来"捕捉"CO 2,并将CO 2储存或利用,流程如图。
下列有关该过程的叙述正确的是 ;(填序号)
A.该过程可实现CO 2零排放
B.该过程只有2种物质可以循环利用
C.反应分离室中分离物质的操作是蒸发、结晶
D.该过程至少发生了4个化学反应
②途径二:将CO 2转化为甲醇(CH 3OH),其反应的微观过程如图2所示,上述反应的化学方程式为 。
金属在日常生活,工农业生产和科学研究方面应用广泛.
(1)铜可用来制作导线,是因为其具有良好的延展性和 .
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是 .
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行如表实验
实验序号 |
实验过程 |
实验现象 |
1 |
镁粉和铁粉分别与5%盐酸反应 |
镁粉产生气体快 |
2 |
铁粉和铁片分别与15%盐酸反应 |
铁粉产生气体快 |
3 |
铁片分别与5%盐酸和15%盐酸反应 |
15%盐酸产生气体快 |
由此得出影响金属与酸反应快慢的因素有:
a: b: c:
(4)小明将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液.
①锌和硝酸银溶液反应的化学方程式是 .
②若滤液为蓝色,则滤液中一定含有的金属离子是 (写离子符号)
铅蓄电池在生产、生活中使用广泛。其构造示意图如图1,回答下列问题:

(1)铅蓄电池充电时是将电能转化为 (填序号)。
a、机械能 b、热能 c、化学能
(2)铅蓄电池放电过程中,反应的化学方程式为Pb+PbO 2+2H 2SO 4═2PbSO 4+2H 2O,据此可知,铅蓄电池在放电时,溶液的pH不断 (填"增大"、"减小"或"不变")。
(3)如图2是回收废铅蓄电池的一种工艺流程:
①从材料分类角度看,塑料是一类 材料。
②废硫酸可以与氟磷灰石[Ca 5(PO 4) 3F]反应,反应的化学方程式为2Ca 5(PO 4) 3F+7H 2SO 4═3CaSO 4+3Ca(H 2PO 4) 2+2HF,反应产物中可用作化肥的物质是 。
③如表是一些金属熔点的数据:
金属 |
锡 |
铅 |
铋 |
镉 |
熔点∕℃ |
231.9 |
327.5 |
271.3 |
320.9 |
日常所用保险丝由铋、铅、锡、镉等金属组成,其熔点约为 (填序号)
A.300﹣320℃
B.230﹣250℃
C.60﹣80℃
D.20﹣40℃
④废硫酸直接排放会污染环境,拟选用如表物质中和后再排放:
物质 |
CaCO 3 |
Ca(OH) 2 |
NH 3 |
NaOH |
市场参考价(元/kg ) |
1.8 |
2.0 |
6.5 |
11.5 |
已知:2NH 3+H 2SO 4═(NH 4)SO 4,如果要求花最少的钱来中和等质量、等浓度的废硫酸,则应选择 (填序号)。
a、CaCO 3 b、Ca(OH) 2c、NH 3d、NaOH。
实验技能是学习化学和进行探究活动的基础和保证。

(1)实验室配制50g质量分数为6%的NaCl溶液,用到的玻璃仪器除试剂瓶、量筒、胶头滴管外,还需要 。量取读数时,如图视线角度正确的是 (填序号)。
(2)请根据如图装置或操作回答相关问题。
①选取图2中的序号,表示粗盐提纯的正确操作顺序为 。操作B的名称是 ,该操作中当 时,应停止加热。
②实验室用高锰酸钾固体制取氧气时,可选用的发生装置是 (填序号)。
某化学兴趣小组用如图装置验证一氧化碳还原氧化铜,并探究其还原产物的组成.

(1)装置及反应原理探究
①B装置中浓硫酸的作用为 .
②说明CO能还原CuO的现象为 .
③上述整套装置中发生的化学反应,其中属于化合反应的化学方程式 .(不考虑CO 2和H 2O的反应.)
(2)产物成分探究
【查阅资料】Ⅰ、一氧化碳还原氧化铜.除生成铜外还可能生成氧化亚铜(Cu 2O)
Ⅱ、Cu 2O为不溶于水的红色固体
Ⅲ、Cu 2O+H 2SO 4═Cu SO 4+Cu+H 2O
【提出问题】红色固体含有什么物质?
【猜想假设】假设一:红色固体只含Cu
假设二:红色固体只含Cu 2O
假设三: .
【实验验证】该小组为验证上述假设,取少量红色固体,加到足量稀硫酸中,观察到溶液变为蓝色,红色固体部分溶解.
【实验结论】根据上述实验结果,可知红色固体中一定含有 .
【数据处理】为进一步确定红色固体的成分,甲、乙两同学分别称取各自实验后的一定质量的红色固体,加到足量稀硫酸中使其充分反应,经过滤、洗涤、干燥后,称量剩余红色固体质量如表,请完善表中内容.
实验人员 |
红色固体(g) |
剩余红色固体(g) |
实验结论 |
甲 |
7.2 |
3.2 |
|
乙 |
4.08 |
2.48 |
|
【交流与反思】只要假设合理,方法正确,根据实验现象和数据就能得出结论.
向53g质量分数为10%的碳酸钠溶液中逐滴加入质量分数为5%的稀盐酸,生成二氧化碳的质量随加入盐酸质量的变化关系如图所示。(不考虑CO 2的溶解)
已知:
OB段反应的化学方程式为Na 2CO 3+HCl═NaCl+NaHCO 3
BD段(不含B点)反应的化学方程式为NaH CO 3+HCl═NaCl+H 2O+CO 2↑
请回答:
(1)53g质量分数为10%的碳酸钠溶液中溶质质量为 g。
(2)A点对应溶液中溶质有 (填化学式)。
(3)B点横坐标为 (计算结果保留1位小数,下同)
(4)假设C点横坐标为54.75,计算C点对应的二氧化碳质量。(写出计算过程)





 闻气体气味
闻气体气味 添加酒精
添加酒精 加热液体
加热液体 滴加液体
滴加液体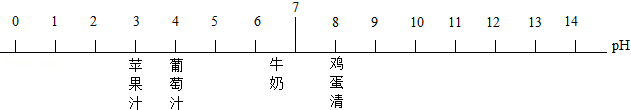
 一定量的MgSO 4溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液质量的关系
一定量的MgSO 4溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液质量的关系 相同质量的Mg、Fe分别与足量的同浓度稀硫酸反应,氢气的质量与反应时间的关系
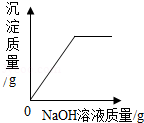
相同质量的Mg、Fe分别与足量的同浓度稀硫酸反应,氢气的质量与反应时间的关系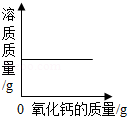 一定量的饱和石灰水中加入氧化钙,溶液中溶质质量与加入氧化钙质量的关系
一定量的饱和石灰水中加入氧化钙,溶液中溶质质量与加入氧化钙质量的关系 向氢氧化钠溶液中不断加水,溶液的pH与加入水的质量的关系
向氢氧化钠溶液中不断加水,溶液的pH与加入水的质量的关系 粤公网安备 44130202000953号
粤公网安备 44130202000953号