2016年广西桂林市中考化学试卷
规范操作是实验顺利进行和人身安全的保证,下列操作正确的是( )
A.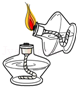 点燃酒精灯B.
点燃酒精灯B.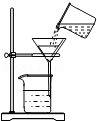 过滤
过滤
C.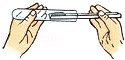 向试管里加粉末D.
向试管里加粉末D. 量取液体
量取液体
下列关于铁的说法,正确的是( )
A.用水可以除去铁锈
B.铁在潮湿空气中容易生锈
C.铁生锈不是缓慢氧化
D.铁部分锈蚀后没有回收价值
有人认为“氮肥壮叶,磷肥壮果,钾肥壮茎”,小王家的柑橘树结的果实偏小,小王应向柑橘树施加下列化肥中的( )
A.硫酸钾B.硫酸铵C.碳酸氢铵D.过磷酸钙
家用LED台灯常用到砷化镓(GaAs),已知砷化镓中Ga的化合价为+3价,则As的化合价为( )
A.﹣2B.﹣3C.﹣4D.﹣5
已知化学反应:4Al+3MnO2 3Mn+2Al2O3,该反应属于基本反应类型中的( )
3Mn+2Al2O3,该反应属于基本反应类型中的( )
A.化合反应B.分解反应C.置换反应D.复分解反应
下表是几种作物适宜生长的pH范围:
作物 |
马铃薯 |
茶树 |
水稻 |
莲 |
pH |
4.8~5.5 |
5.0~5.5 |
6.0~7.0 |
8.0~9.0 |
某地土壤呈碱性,则该地适宜种植的作物是( )
A.马铃薯B.茶树C.水稻D.莲
下列化学方程式正确的是( )
A.Na+Cl2 NaClB.H2O2
NaClB.H2O2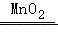 H2↑+O2↑
H2↑+O2↑
C.4P+5O2═2P2O5D.Fe+CuSO4═FeSO4+Cu
下列实验操作和对应的现象,正确的是( )
A.在空气中点燃镁条,火星四射
B.在空气中加热铜片,铜片表面变白
C.在空气中点燃氢气,火焰呈淡蓝色
D.向氯化铁溶液中滴加氢氧化钠溶液,有白色沉淀产生
下列应用,利用了氧气物理性质的是( )
A.工业上用空气制氧气B.用氧气气焊金属
C.氧气供潜水员呼吸D.用氧气炼钢
下列实验方案,不合理的是( )
选项 |
实验目的 |
实验操作 |
A |
检验Cl﹣ |
先加AgNO3溶液,再加稀HNO3 |
B |
检验CO2 |
用燃着的木条伸入集气瓶内 |
C |
检验O2 |
用带火星的木条伸入集气瓶内 |
D |
检验NH4+ |
加NaOH溶液,微热,用湿润的红色石蕊试纸检验生成的气体 |
A.AB.BC.CD.D
小明向盛有盐酸和MgCl2溶液的烧杯中加入一定量的NaOH溶液,为判断反应后溶液的成分,他分别取少量反应后的溶液a于试管中,用下表中的试剂进行实验,相应结果错误的是( )
选项 |
试剂 |
现象和结论 |
A |
Zn粉 |
有气泡产生,则溶液a一定MgCl2 |
B |
CuO粉末 |
无明显现象,则溶液a一定有两种溶质 |
C |
NaOH溶液 |
无明显现象,则溶液a可能有NaOH |
D |
CuSO4溶液 |
有蓝色沉淀,则溶液a一定有两种溶质 |
A.AB.BC.CD.D
由乙炔(C2H2)、乙烯(C2H4)、乙烷(C2H6)组成的混合物28g,在足量的氧气中燃烧,生成36gH2O和一定质量的CO2,混合物中C2H2、C2H4、C2H6的分子个数比可能为( )
A.3:2:3B.3:2:1C.1:2:3D.6:3:2
人类社会需要充足的能源、丰富的材料、良好的环境,而能源、材料、环境这三个领域的研究都离不开化学.
(1)塑料是常用的有机合成材料,塑料垃圾随意抛弃,会造成所谓“ ”,下列物品所含的主要材料属于有机合成材料的是 .
A.玻璃杯 B.矿泉水瓶 C.硬币 D.瓷碗
(2)天然气是一种清洁能源,它的主要成分甲烷(CH4)完全燃烧的化学方程式是 .
(3)碳不完全燃烧产生的 会造成“煤气中毒”,在日常生活中,避免“煤气中毒”的方法是 (写一种).等质量的碳完全燃烧放出的热量 (填“大于”、“等于”或“小于”)其不完全燃烧放出的热量.
化学与人体健康息息相关.
(1)下列食物中富含蛋白质的是 (填字母序号).
A.鱼肉 B.米饭 C.西红柿 D.苹果
(2)缺 (填元素名称)会引起甲状腺肿大,食用富含该元素的海产品如 (填一种)有利于人体摄取该元素.
(3)下列生活中的做法,不会危害人体健康的是 (填字母序号).
A.吸烟 B.过量饮酒 C.均衡饮食 D.食用霉变花生.
河水含泥沙、细菌等杂质,需要净化处理成自来水,某市自来水厂的生产过程如图所示.

(1)为了使沉淀池的悬浮物沉降,通常可加入 .
(2)沙滤池可将 过滤除去.
(3)活性炭常用于吸附池中,原因是它具有 的结构.
(4)常用于杀菌池消毒的物质有多种,请写出其中一种物质的化学式 .
(5)要鉴别自来水是软水还是硬水,可向自来水样品中加入适量的 ,搅拌,如果观察到 ,则样品为软水.
如表是硝酸钾、氯化钠在不同温度下的溶解度.
温度/℃ |
10 |
20 |
30 |
40 |
50 |
硝酸钾的溶解度/g |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
氯化钠的溶解度/g |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
(1)从表中数据分析,溶解度受温度影响较大的物质是 ,硝酸钾和氯化钠溶解度曲线的交点在 (填字母序号)之间.
A.20℃~30℃B.30℃~40℃C.40℃~50℃
(2)20℃,将50g硝酸钾与100g水混合,充分搅拌后静置,得到的溶液是硝酸钾的 (“饱和”或“不饱和”)溶液,若将温度升高到40℃,该溶解溶质的质量分数为 (精确到0.1%).
(3)保持温度为20℃,将氯化钠的不饱和溶液变成饱和溶液,写出一种可行的方法 .
多数金属以矿物形式存在于自然界,金属矿物可用来冶炼金属.
冶炼方法 |
反应表示式(其他产生略去) |
代表性金属 |
热还原法 |
金属A的氧化物+碳(或一氧化碳等) |
锌、铜 |
电解法 |
金属B的化合物 |
钾、铝 |
热分解法 |
金属C的氧化物 |
汞、银 |
(1)工业上常用赤铁矿(主要成分是Fe2O3)与CO在高温下炼铁,反应的化学方程式是 .
(2)用氧化铝冶炼金属铝的化学方程式是 .
(3)若从铅的矿物中冶炼铅,可使用上述方法中的 ,理由是 .
A、B、C、D都是初中化学中最常见的物质,已知B是人体胃酸的主要成分,D含有钠元素,A含有两种元素,C、D分别含有三种元素,它们之间存在着以下转化关系,A在一定条件下可以转化为C,B可分别与A、C、D反应,C与D可以反应.
(1)A属于化合物中的 (“酸”、“碱”、“盐”或“氧化物”).
(2)反应A→C属于基本反应类型中的 反应,D溶液与足量的B反应的现象是 .
(3)C与D反应的化学方程式是 .
如图是初中化学中的一些常用实验仪器或装置:

(1)实验室用高锰酸钾制取氧气的化学方程式是 ,常用来收集氧气的装置是 (填字母序号).
(2)小李要配制50g质量分数为10%的NaCl溶液,并装入试剂瓶备用.
①要完成该实验,如图中还缺少的仪器是 (填名称).
②该实验过程中,玻璃棒的作用是 .
(3)用试纸测定溶液pH值的方法是:将小片pH试纸放在洁净的玻璃片上, ,与标准比色片比较,读出pH,若pH试纸事先用水湿润,测出的食醋pH值 (填“偏大”、“偏小”或“没有影响”).
课堂上,老师取20g蔗糖放入小烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌,同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是碳,原因是浓硫酸具有强 .
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动.
【猜想与假设】浓硫酸与碳反应,生成大量气体使黑色固体膨胀.
【查阅资料】
Ⅰ.浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体.
Ⅱ.SO2是一种具有刺激性气味的气体,能与Ca(OH)2溶液反应生成白色沉淀.
Ⅲ.SO2能使品红溶液褪色,而CO2不能.
【实验探究】
为验证碳与浓硫酸在加热条件下生成的气体产物,同学们在老师指导下设计并进行如图实验:

【事实与结论】
(1)请将能得出对应结论的实验现象填入表中.
验证气体 |
实验现象 |
实验结论 |
SO2 |
|
有SO2产生 |
CO2 |
|
有CO2产生 |
(2)碳与浓硫酸反应的化学方程式是 .
(3)浓硫酸与碳在加热条件下产生大量的SO2和CO2,使黑色固体膨胀,形成“黑面包”,猜想成立.
【反思与交流】
(1)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是 .
(2)若B、E中试剂交换, (填“能”或“不能”)得出有CO2产生的结论,理由是 .
(3)C中酸性高锰酸钾溶液的作用是 .
 量筒B.
量筒B. 试管C.
试管C. 烧杯D.
烧杯D. 集气瓶
集气瓶
 金属A
金属A 金属B
金属B C6H15O7N(葡萄糖酸铵)+2Ag↓+3NH3↑+H2O.请回答以下问题.
C6H15O7N(葡萄糖酸铵)+2Ag↓+3NH3↑+H2O.请回答以下问题. 粤公网安备 44130202000953号
粤公网安备 44130202000953号