2016年福建省漳州市中考化学试卷
"促进可持续的生活方式","践行绿色生活".下列措施不符合建设"生态漳州"的是( )
| A. |
不向水中丢垃圾 |
| B. |
生活污水任意排放 |
| C. |
合理使用农药化肥 |
| D. |
严查工厂排放的水是否达标 |
祖国文化灿烂辉煌.有关诗句"春蚕到死丝方尽,蜡炬成灰泪始干",理解错误的是( )
| A. |
蚕"丝"是天然纤维 |
| B. |
"蜡炬成灰"只发生化学变化 |
| C. |
"泪"指液态蜡 |
| D. |
"灰"是指蜡燃烧产生的CO 2等物质 |
下列物质所对应的俗名,错误的是( )
| A. |
NaOH烧碱 |
B. |
Na 2CO 3纯碱 |
C. |
CaO生石灰 |
D. |
NaHCO 3火碱 |
漳州市诏安县红星乡是"长寿之乡",与当地富硒有关.如图是硒(Se)原子的结构示意图,下列描述错误的是( )

| A. |
是相对稳定结构 |
B. |
核电荷数为34 |
| C. |
共有4个电子层 |
D. |
第二层上有8个电子 |
下列情况中,铁钉容易生锈的是( )
| A. |
在干燥的空气中 |
B. |
浸没在蒸馏水中 |
| C. |
部分浸入食盐水中 |
D. |
浸没在植物油中 |
运用如图所示装置探究可燃物的燃烧条件,下列说法错误的是( )

| A. |
①②现象对比,说明温度达到可燃物的着火点是燃烧条件之一 |
| B. |
①③现象对比,说明有氧气参与是燃烧条件之一 |
| C. |
白磷的着火点低于80℃ |
| D. |
热水只起到加热作用 |
下列说法错误的是( )
| A. |
点燃H 2前,要先检验其纯度 |
| B. |
堆放易燃易爆物,不要堆得过密 |
| C. |
金刚石、石墨和C 60的化学性质相同 |
| D. |
稀释浓硫酸时,要把浓硫酸沿器壁缓慢注入水里,并不断搅拌 |
下列实验方案不能达到实验目的是( )
实验目的 |
实验方案 |
A.除去硫酸锌溶液中混有的少量硫酸铜 |
往溶液中加入足量的锌粉,过滤 |
B.检验氧气 |
将带火星的木条伸入集气瓶中,看是否复燃 |
C.鉴别氢气和氮气 |
闻气体气味,根据气体气味判断 |
D.鉴别二氧化碳和一氧化碳 |
点燃,看是否能燃烧 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下列现象描述正确的是( )
| A. |
碳和氧化铜反应后,黑色的氧化铜变成灰色 |
| B. |
往硫酸铜溶液中滴加氢氧化钠溶液有白色沉淀生成 |
| C. |
往5%过氧化氢溶液中加入二氧化锰有大量氧气生成 |
| D. |
硫在氧气中燃烧,产生明亮的蓝紫色火焰,生成有刺激性气味的气体 |
甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )

| A. |
甲物质的溶解度大于乙物质的溶解度 |
| B. |
两种物质的溶解度都随着温度的升高而增大 |
| C. |
t 1℃时,60g甲加入到100g水中,充分溶解,得到160g溶液 |
| D. |
甲、乙的饱和溶液从t 2℃降温到t 1℃,析出晶体的质量:甲一定小于乙 |
下列有关说法,错误的是( )
| A. |
酸雨是pH<7的降雨 |
| B. |
白色污染是废弃塑料造成的污染 |
| C. |
将二氧化碳转化为新型燃料,有利于减缓温室效应 |
| D. |
运用CNG(压缩天然气)作为汽车燃料,可以减少汽车尾气对空气的污染 |
如图表示四种物质的密闭容器中反应一段时间后质量的变化,则其化学反应表达式可能是( )
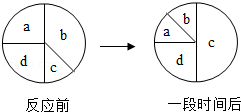
| A. |
a+b→c+d |
B. |
c→a+b |
C. |
a+b c |
D. |
c a+b |
(1)喝口水缓解考试压力,我带的开水是 (填"纯净物"或"混合物"),它已经通过 降低了水的硬度.
(2)化学考试结束回到家,啊,餐厅里飘来了饭的香味,这是因为 (从微观角度解释)…先吃一碗带汤排骨,再吃碗干饭拌青菜.这些食物中除了水、无机盐和油脂外,主要含有的营养素是 、 、 .
(3)家里煮菜用液化石油气,除了石油外,化石燃料还有 、 .液化石油气的主要成分C 4H 8完全燃烧的产物是二氧化碳和水,则其完全燃烧的化学方程式是 .
充有的蒸汽的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明.钠的化学性质活泼,常温下可以与氧气、水反应,在实验室里,金属钠保存在煤油中,用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入盛有水(滴有酚酞溶液)的烧杯中,发现钠块浮在水面上,很快熔化成银白色小球,四处游动,发出嘶嘶的响声,偶有火星出现,溶液变成红色.依据提供的信息,回答下列问题.
(1)"钠保存在煤油中"说明钠具有的化学性质是 .
(2)"钠块浮在水面上"说明钠具有的物理性质是 .
(3)"溶液变成红色"说明钠与水反应的生成物中含有 性的物质.
(4)根据所学知识解释钠"熔化成银白色小球"的原因是 .

回收利用是保护金属资源的一条有效途径,某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液.主要流程如图:

已知:CuO+H 2SO 4═CuSO 4+H 2O Fe+Fe 2(SO 4) 3═3FeSO 4
(1)流程Ⅰ中氧化铁发生反应的化学方程式是 .
(2)流程Ⅲ充分反应后,还应有的实验操作是 .
(3)A﹣E中,含有铁、铜两种元素的是 (填字母).
世界是物质的,物质是由元素组成的,从H、C、N、O、Ca中选择适当的元素组成物质填空.
(1)最简单的有机化合物是 ;
(2)具有可燃性的气体单质是 ;
(3)可用于人工降雨的物质是 ;
(4)有毒且能作为气体燃料的氧化物是 ,它燃烧的化学方程式是 ;
(5)可用来改良酸性土壤的碱是 ,它与稀盐酸反应的化学方程式是 .
对物质进行归纳、分类,是学习化学的重要方法.
(1)如图是一位同学整理的有关CO 2的知识网络图.
物质①的化学式是 ;物质②的组成元素有 种;物质③中的阳离子符号是 ;写出CO 2转化为物质④的化学方程式 ;物质⑤中碳元素的化合价是 价。
(2)根据下列信息回答问题.
①能与碱反应生成盐和水的氧化物叫做酸性氧化物.
②SO 2+2NaOH═Na 2SO 3+H 2O
以上物质中属于酸性氧化物的是 ,初中学过的 也是酸性氧化物;酸性氧化物一般是 氧化物(填"金属"或"非金属")

如图是某反应的微观粒子示意图。
(1)根据化学反应的本质,反应物的方框内还应补充的粒子及数目是 。
A.一个  B.两个
B.两个  C.一个
C.一个  D.两个
D.两个 
(2)两种生成物分子的共同之处是 ,该反应属于基本反应类型中的 反应。

(1)写出图1A中一种玻璃仪器的名称 。
(2)用高锰酸钾制取氧气时,选用的发生装置是 (填序号,下同),收集装置是 ;装药品时还需要的实验用品是 ,反应的化学方程式是 。
(3)如图2是a、b、c三部分组成的实验装置图。a处反应的化学方程式是 ;b处的现象是 ;一段时间后,c处0以上的棉花团比0以下的棉花团变红色的个数 (填“多”或“少”),原因是 。

漳州小吃手抓面,制作时要用发到大树碱,大树碱的主要成分是K 2CO 3.为了测定大树碱中K 2CO 3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是 .
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是 .
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是 .
(4)向配好的溶液中逐渐加入CaCl 2溶液,生成1g沉淀(假设大树碱中其它成分不参与反应,反应的化学方程式为CaCl 2+K 2CO 3═CaCO 3↓+2KCl).计算大树碱中K 2CO 3的质量分数?(要写出计算过程)
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K 2CO 3的质量分数 (填"偏大"或"偏小")

[题干]在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有 产生,反应的化学方程式是 .
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀.
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因.
试管(盛有同体积同浓度的盐酸) |
① |
② |
③ |
④ |
镁条长度 |
1cm |
2cm |
3cm |
4cm |
相同的实验现象(省略题干现象) |
快速反应,试管发热,镁条全部消失 |
|||
沉淀量差异(恢复至20℃) |
无 |
少量 |
较多 |
很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与 有关.
[追问]白色沉淀是什么物质?
[查阅资料]①20℃时,100g水中最多能溶解氯化镁54.8g.
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸.
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是 (用化学方程式表示).
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 |
操作 |
现象 |
结论 |
A |
加入足量盐酸 |
,白色沉淀 |
猜想一不正确,但这种白色沉淀能溶于盐酸 |
B |
加入足量水 |
白色沉淀 |
猜想二不正确 |
C |
加入适量稀硝酸 |
白色沉淀消失 |
原白色沉淀中含有的离子是: Mg 2+、 |
继续滴加几滴硝酸银溶液 |
出现大量白色沉淀 |
[拓展延伸]足量镁与盐酸反应过程中,溶液会经历从酸性到碱性并且碱性逐渐增强的过程,从而促使白色碱式氯化镁的生成.
 检查气密性
检查气密性 点燃酒精灯
点燃酒精灯 滴加液体
滴加液体 测定溶液的pH
测定溶液的pH 粤公网安备 44130202000953号
粤公网安备 44130202000953号