2016年江苏省常州市中考化学试卷
下列各种铜矿石的主要成分中,含元素种类最多的是( )
| A. |
赤铜矿(Cu 2O) |
B. |
辉铜矿(Cu 2S) |
| C. |
斑铜矿(Cu 3FeS 4) |
D. |
孔雀石[Cu 2(OH) 2CO 3] |
下列关于"石头纸"与普通纸的叙述中,错误的是( )
| A. |
"石头纸"比普通纸更坚固 |
B. |
"石头纸"比普通纸更易燃 |
| C. |
"石头纸"比普通纸更环保 |
D. |
可用稀盐酸区别"石头纸"与普通纸 |
铬酸铅可用作黄色涂料,常用以下方法制取:K 2CrO 4+Pb(NO 3) 2═PbCrO 4↓+2KNO 3,该反应属于( )
| A. |
化合反应 |
B. |
分解反应 |
C. |
置换反应 |
D. |
复分解反应 |
下列情况下,埋在地下的铸铁最易生锈的是( )
| A. |
在潮湿、疏松、透气的土壤中 |
B. |
在干燥、疏松、透气的土壤中 |
| C. |
在潮湿、致密、不透气的土壤中 |
D. |
在干燥、致密、不透气的土壤中 |
垃圾箱常有绿、黄两色,绿色箱盛装可回收利用的垃圾、黄色箱盛装不可回收的垃圾,下列物质应投入黄色箱的是( )
| A. |
废铝线 |
B. |
旧报纸 |
C. |
易拉罐 |
D. |
口香糖 |
下列关于原子的叙述中,正确的是( )
| A. |
是带电的微粒 |
B. |
是实心球体 |
| C. |
可分解为分子 |
D. |
可转变成离子 |
表提供了KNO 3在不同温度时的溶解度,据该表判断,下列叙述中,错误的是( )
温度(℃) |
0 |
20 |
40 |
60 |
80 |
溶解度(g) |
13.3 |
31.6 |
63.9 |
110 |
169 |
| A. |
KNO 3的溶解度随温度的上升而变大 |
| B. |
20℃时,100g饱和KNO 3溶液中含有31.6gKNO 3 |
| C. |
将40℃的KNO 3饱和溶液升温至60℃,该溶液变成不饱和溶液 |
| D. |
将80℃的KNO 3饱和溶液降温至20℃,有晶体析出 |
下列叙述中,正确的是( )
| A. |
不锈钢是永不生锈的钢铁 |
| B. |
用酒精清洗碘单质形成的污渍是乳化的应用 |
| C. |
图书档案起火,用液态二氧化碳灭火器扑灭 |
| D. |
"墙内开花墙外香"主要说明构成物质的微粒间有空隙 |
配制生理盐水时,导致其溶质质量分数偏小的原因可能是( )
①将称好的氯化钠固体转移到烧杯中时,有少量洒出;
②用量筒量取水时,将量筒举过头顶读数;
③溶解过程中未用玻璃棒搅拌;
④盛装生理盐水的试管刷洗后未干燥。
| A. |
仅①④ |
B. |
仅②③ |
C. |
①②④ |
D. |
①③④ |
四种植物花汁在不同酸碱性下呈现的颜色如表所示。若要检测某溶液的酸碱性,最好选用( )
pH |
<7 |
=7 |
>7 |
玫瑰花汁 |
粉红 |
粉红 |
黄 |
万寿菊花汁 |
黄 |
黄 |
黄 |
大红花汁 |
橙 |
粉红 |
绿 |
万年青花汁 |
橙黄 |
浅绿 |
浅绿 |
| A. |
玫瑰花汁 |
B. |
万寿菊花汁 |
C. |
大红花汁 |
D. |
万年青花汁 |
甲、乙、丁、X的转化关系如图所示(反应条件和部分产物已略去,"→"表示一步转化)。下列各项中,不能满足图示转化关系的是( )

甲 |
乙 |
丁 |
X |
|
A |
化合物 |
化合物 |
单质 |
单质 |
B |
酸 |
碱 |
氧化物 |
氧化物 |
C |
盐 |
碱 |
碱 |
氧化物 |
D |
金属 |
盐 |
盐 |
碱 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
密闭容器中盛有CH 4、N 2和O 2的混合气,点火使其充分反应,CH 4全部转化为CO、CO 2和H 2O,待容器恢复至室温,测得容器内的混合气中碳元素的质量分数为12%,则反应前混合气中N 2的质量分数可能为( )
| A. |
28% |
B. |
42% |
C. |
54% |
D. |
64% |
用符号要求的物质的字母填空。
| A. |
石墨 |
B. |
小苏打 |
C. |
食盐 |
D. |
天然气 |
(1)常用做调味品的是 ;
(2)常用作电池电极的是 ;
(3)常用于家庭燃料的是 ;
(4)常用于焙制糕点的是 。
判断下列大小或强弱关系,并用“<”、“>”或“=”填空。
(1)金属活动性:锌 铜;
(2)受热稳定性:碳酸钙 碳酸氢铵;
(3)相同条件下的密度:空气 二氧化碳;
(4)相同条件下的挥发性:稀盐酸 浓盐酸。
工业炼铁。
(1)工业炼铁的主要设备是 ;
(2)工业炼铁的原料包括 (填字母):
A.焦炭 B.铁矿石 C.烧碱 D.热空气
(3)下列矿石主要成分为Fe3O4的是 (填字母):
A.赤铁矿 B.磁铁矿 C.黄铁矿
(4)写出CO与Fe2O3反应方程式: 。
“宏微观相结合”、“定性研究和定量研究相结合”是研究化学反应的重要方法。以下是运用上述方法认识红磷燃烧反应的过程,请完成下列问题。
(1)写出红磷燃烧的化学方程式: ;
(2)定性认识,从宏观角度讲,该反应产生了新的物质五氧化二磷;从微观角度讲,该反应产生了新的 ;
(3)定量认识,从宏观角度讲, 的总质量等于反应后生成的P2O5的质量;从微观角度讲,磷、氧 的总个数在反应前后保持不变;
(4)现有62g红磷,要使其完全燃烧,至少需要O2多少克?(需写出计算过程)
实验Ⅰ:实验室制O 2。
【实验装置】如图1所示。
【实验步骤】
①检查装置气密性;
②向锥形瓶中加入MnO 2,塞进带导管和仪器A的双孔橡皮塞,关闭活塞C,向A中添加双氧水,塞上塞子B,将导管放入底部有少量黄沙的集气瓶中,盖上玻璃片;
③ ,控制活塞C,逐渐滴加双氧水,收集O 2并验满。
(1)写出仪器A的名称: ;
(2)步骤①中,检查装置气密性的方法是: ;
(3)步骤②中,塞进双孔橡皮塞的方法是: ;
(4)步骤③中,验满的方法是: ;
(5)若用图2装置收集O 2,则O 2由 端通入(填"a"或"b");
(6)下列关于本实验的叙述中,错误的是 :
A.为了快速获得O 2,双氧水的浓度越大越好
B.在橡皮管上增加水夹,可控制反应的开始与停止
C.在装置Ⅰ,Ⅱ间增加装有生石灰的U形管,可制得干燥O 2;
实验Ⅱ:铁丝在O 2中燃烧、
(1)该反应的化学方程式为: ;
(2)该反应的现象为:放热、火星四溅,生成 色固体;
(3)实验表明:改用加热KMnO 4制取、并用向上排空气法收集O 2进行本实验,成功率更高,原因可能是 。

闪锌矿(主要成分为ZnS)经熔烧得锌熔砂,锌熔砂主要含ZnO、ZnFe 3O 4,以及少量FeO、CuO,工业上用其制备金属锌,具体过程如图所示。
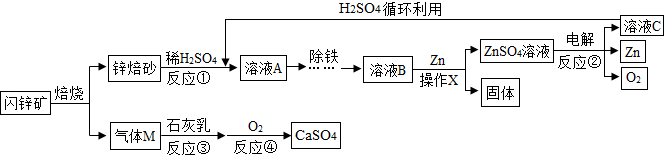
(1)操作X的名称是 ;
(2)进行反应①时,要将锌熔砂粉粹成细小颗粒,目的是 ;
(3)ZnFe 2O 4可看作两种氧化物的结合,它与稀H 2SO 4反应生产两种盐,分别是ZnSO 4和 (填化学式)。
(4)参加反应②的物质为ZnSO 4和 (填化学式);
(5)写出反应③的化学方程式: 。
莫凡同学完成镁与稀盐酸反应的实验后,观察到有灰白色沉淀生成的"异常"现象,引起了他的兴趣,并进行了以下探究。
【初步探究】出现灰白色沉淀是否为偶然现象。
【实验Ⅰ】向4份相同体积与浓度的稀盐酸中分别加入一定长度的某种镁带,现象如下:
实验组别 |
A |
B |
C |
D |
镁带长度 |
1cm |
2cm |
3cm |
4cm |
沉淀量 |
无沉淀生成 |
少量沉淀 |
沉淀较多 |
沉淀很多 |
【实验结论】并非偶然,据表分析, 是实验出现"异常"的主要因素。
【再次探究】该沉淀的成分
【猜想假设】猜想1:Mg;猜想2:MgCl 2
【实验Ⅱ】
序号 |
实验操作 |
实验现象 |
实验结论 |
① |
取1g样品,加入足量 ,振荡 |
未见气泡 |
猜想1错误 |
② |
取1g样品,加入5mL蒸馏水,振荡 |
沉淀未溶解 |
猜想2错误 |
③ |
取1g MgCl 2固体,加5mL蒸馏水,振荡 |
固体全部溶解 |
【交流讨论】
(1)莫凡同学做出猜想Ⅰ的依据是他认为反应物Mg过量,作出猜想2的依据是他认为生成物MgCl 2 。
(2)从实验设计的角度讲,实验③的作用是 。
【深入探究】该沉淀的物质组成
【查阅资料】
灰白色沉淀的成分为碱式氯化镁,它存在多种组成,化学式可表示为Mg x(OH) yCl z•nH 2O[即每份Mg x(OH) yCl z结合了n份H 2O],它受热分解可产生氧化镁、氯化氢和水。
【实验Ⅲ】
洗去沉淀表面杂质并室温晾干,取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验,待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g。
【问题讨论】
(1)反应停止后,应继续通入N 2一段时间,目的是 。
(2)该沉淀中,镁、氯的离子个数比n(Mg 2+):n(Cl ﹣)= 。
(3)若沉淀Mg x(OH) yCl z•nH 2O中,n=5,则X、Y、Z的数值依次为 。

DIY冰淇淋,配料:奶油、鲜牛奶、蔗糖、生鸡蛋、香兰素(分子式为C 8H 8O 3)。将上述配料加入金属容器中,搅拌均匀,再向容器中加入适量液氮,继续搅拌至均匀无结块时,美味的冰淇淋就可以品尝了。
(1)鸡蛋蛋清中含有的营养物质主要是 ;向蛋清浓溶液中滴加饱和硫酸铵溶液,可以观察到有 生成;
(2)每个香兰素分子由 个原子构成,其中碳元素的质量分数为 %(保留一位小数);
(3)美味冰淇淋的制作秘诀在于速冻,此过程中,液氮变成氮气,该变化属于 变化(填"物理"或"化学");
(4)若制作时没液氮,也可使用 代替。
利用如图1装置,小卫设计并实施了下列实验,(压强传感器用于测量抽滤瓶内压强变化:各数据均于同温下测定获得)

实验Ⅰ:再小试管中加入8mL溶质质量分数为3%的双氧水(ρ=1g/mL),在抽滤瓶中分别加入不同质量的MnO 2,使其反应并启动传感器,记录容器内压强变化于图2中。
实验Ⅱ:在抽滤瓶中加入0.1g MnO 2,在小试管中分别加入不同体积溶质质量分数为3%的双氧水,使其反应并启动传感器,记录容器内压强变化于图3中。
请根据以上实验回答下列问题:
(1)使容器内压强增大的反应的化学方程式: 。
(2)根据图2可发现,该实验条件下,30s内催化分解8mL溶质质量分数为3%的双氧水,MnO 2的最小用量为 g;
(3)根据图3可发现,0.1g MnO 2至少能快速催化分解 g过氧化氢;
(4)根据图2与图3可发现,MnO 2的用量总体上与O 2产量 (填"正相关"、"不相关"或"负相关"),根据图3还可发现,该试验中,O 2产量总体上与双氧水用量是 (填"正比"或"反比");
(5)下列因素中,与本实验所测数据的精确度有关的是
| A. |
反应容器的气密性 |
| B. |
称量MnO 2质量的精准度 |
| C. |
量取双氧水体积的精准度。 |
我国拥有地球上7%的耕地,但化肥使用量却占全球总量的35%,认识化肥,科学施肥至关重要。
(1)下列物质中,可用作磷肥的是 :
A.K 2SO 4 B.CO(NH 2) 2 C.KNO 3 D.Ca(H 2PO 4) 2
(2)NH 4Cl是常见的氮肥,不能与碱性物质混用,否则会因释放出 而损失肥效;
(3)过度使用化肥造成的后果有:① ;②水体富营养化等;
(4)"雷雨发庄稼"现象涉及的化学反应较为复杂,其中一个反应是NO 2与H 2O反应生成HNO 3和NO,写出该反应的化学方程式: ;该反应中。化合价发生改变的元素是_ (填元素符号)。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号